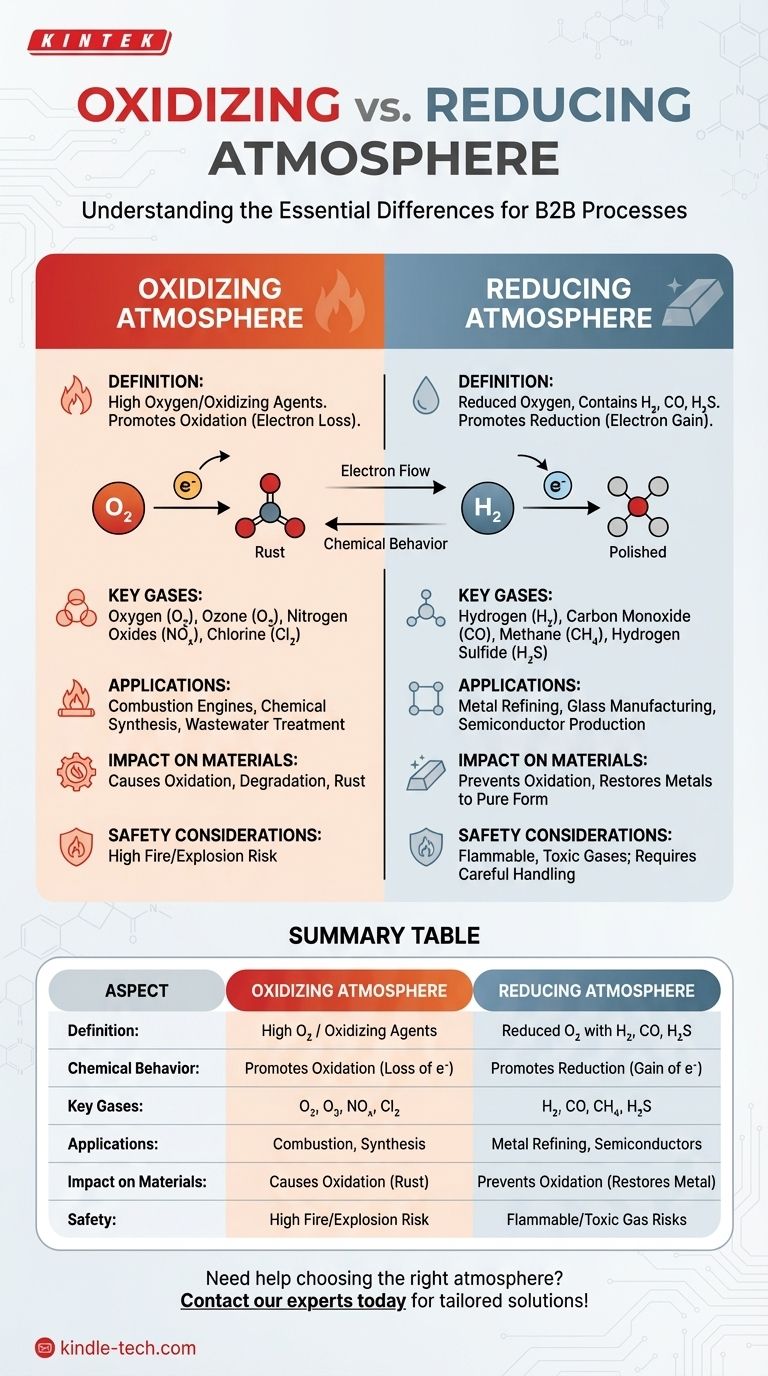
Eine oxidierende Atmosphäre enthält eine hohe Konzentration an Sauerstoff oder anderen Oxidationsmitteln, was Oxidationsreaktionen fördert, während eine reduzierende Atmosphäre eine reduzierte Menge an Sauerstoff aufweist und Gase wie Wasserstoff, Kohlenmonoxid oder Schwefelwasserstoff enthalten kann, die Oxidation verhindern und Reduktionsreaktionen begünstigen. Der Hauptunterschied liegt im chemischen Verhalten der Umgebung: Oxidierende Atmosphären erleichtern den Elektronenverlust (Oxidation), während reduzierende Atmosphären die Elektronenaufnahme (Reduktion) fördern. Diese Unterschiede sind entscheidend in Anwendungen wie der Metallurgie, der chemischen Fertigung und der Materialverarbeitung, wo die Kontrolle der Atmosphäre das Ergebnis von Reaktionen erheblich beeinflussen kann.

Wichtige Punkte erklärt:
-
Definition einer oxidierenden Atmosphäre:
- Eine oxidierende Atmosphäre ist durch eine hohe Konzentration an Sauerstoff oder anderen Oxidationsmitteln gekennzeichnet.
- Sie fördert Oxidationsreaktionen, bei denen Substanzen Elektronen verlieren.
- Häufige Beispiele sind Luft (die ca. 21 % Sauerstoff enthält) und Umgebungen mit Ozon oder Stickoxiden.
- Anwendungen umfassen Verbrennungsprozesse, das Rosten von Metallen und bestimmte chemische Synthesen.
-
Definition einer reduzierenden Atmosphäre:
- Eine reduzierende Atmosphäre enthält eine reduzierte Menge an Sauerstoff und kann Gase wie Wasserstoff, Kohlenmonoxid oder Schwefelwasserstoff enthalten.
- Sie verhindert Oxidation und fördert Reduktionsreaktionen, bei denen Substanzen Elektronen aufnehmen.
- Häufige Beispiele sind Umgebungen, die in metallurgischen Prozessen (z. B. Verhüttung) oder zur Lebensmittelkonservierung (z. B. Vakuumverpackung) verwendet werden.
- Anwendungen umfassen Metallraffination, Glasherstellung und Halbleiterproduktion.
-
Chemisches Verhalten:
- Oxidierende Atmosphäre: Erleichtert den Elektronenverlust von Substanzen, was zur Oxidation führt. Zum Beispiel reagiert Eisen mit Sauerstoff zu Eisenoxid (Rost).
- Reduzierende Atmosphäre: Fördert die Elektronenaufnahme, was zur Reduktion führt. Zum Beispiel kann Wasserstoffgas Eisenoxid wieder zu metallischem Eisen reduzieren.
-
Beteiligte Schlüsselgase:
- Oxidierende Atmosphäre: Sauerstoff (O₂), Ozon (O₃), Stickoxide (NOₓ) und Chlor (Cl₂).
- Reduzierende Atmosphäre: Wasserstoff (H₂), Kohlenmonoxid (CO), Methan (CH₄) und Schwefelwasserstoff (H₂S).
-
Anwendungen und Implikationen:
-
Oxidierende Atmosphäre:
- Wird in Verbrennungsmotoren, der chemischen Synthese (z. B. Herstellung von Schwefelsäure) und der Abwasserbehandlung verwendet.
- Kann im Laufe der Zeit Korrosion oder Materialabbau verursachen.
-
Reduzierende Atmosphäre:
- Wird bei der Metallgewinnung (z. B. Reduktion von Eisenerz zu Eisen), der Glasherstellung (zur Entfernung von Verunreinigungen) und der Lebensmittelverpackung (zur Verhinderung von Verderb) verwendet.
- Verhindert Oxidation und bewahrt die Integrität von Materialien oder Produkten.
-
Oxidierende Atmosphäre:
-
Beispiele in der Industrie:
- Oxidierende Atmosphäre: Bei der Stahlproduktion wird Sauerstoff in geschmolzenes Eisen geblasen, um Verunreinigungen (z. B. Kohlenstoff) durch Oxidation zu entfernen.
- Reduzierende Atmosphäre: Bei der Herstellung von Siliziumwafern für Halbleiter wird eine reduzierende Atmosphäre verwendet, um die Oxidation der Siliziumoberfläche zu verhindern.
-
Auswirkungen auf Materialien:
- Oxidierende Atmosphäre: Kann zur Bildung von Oxiden führen, die Materialien abbauen können (z. B. Rost an Metallen).
- Reduzierende Atmosphäre: Kann Metalle durch Entfernung von Oxiden in ihre reine Form zurückführen (z. B. Reduktion von Eisenoxid zu Eisen).
-
Umwelt- und Sicherheitsaspekte:
- Oxidierende Atmosphäre: Hohe Sauerstoffkonzentrationen können das Risiko von Bränden oder Explosionen erhöhen.
- Reduzierende Atmosphäre: Gase wie Wasserstoff oder Kohlenmonoxid sind brennbar und giftig und erfordern eine sorgfältige Handhabung.
Durch das Verständnis dieser Unterschiede können Einkäufer von Geräten und Verbrauchsmaterialien fundierte Entscheidungen über die Art der Atmosphäre treffen, die für bestimmte Prozesse erforderlich ist, um optimale Ergebnisse und Sicherheit zu gewährleisten.
Zusammenfassungstabelle:
| Aspekt | Oxidierende Atmosphäre | Reduzierende Atmosphäre |
|---|---|---|
| Definition | Hohe Konzentration an Sauerstoff oder Oxidationsmitteln. | Reduzierter Sauerstoffgehalt mit Gasen wie Wasserstoff, Kohlenmonoxid oder Schwefelwasserstoff. |
| Chemisches Verhalten | Fördert Oxidation (Elektronenverlust). | Fördert Reduktion (Elektronenaufnahme). |
| Schlüsselgase | Sauerstoff (O₂), Ozon (O₃), Stickoxide (NOₓ), Chlor (Cl₂). | Wasserstoff (H₂), Kohlenmonoxid (CO), Methan (CH₄), Schwefelwasserstoff (H₂S). |
| Anwendungen | Verbrennungsmotoren, chemische Synthese, Abwasserbehandlung. | Metallraffination, Glasherstellung, Halbleiterproduktion. |
| Auswirkungen auf Materialien | Verursacht Oxidation (z. B. Rost). | Verhindert Oxidation, stellt Metalle in reiner Form wieder her. |
| Sicherheitsaspekte | Hohe Sauerstoffkonzentrationen erhöhen Brand-/Explosionsrisiken. | Brennbare und giftige Gase erfordern sorgfältige Handhabung. |
Benötigen Sie Hilfe bei der Wahl der richtigen Atmosphäre für Ihren Prozess? Kontaktieren Sie noch heute unsere Experten für maßgeschneiderte Lösungen!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Rotationsrohrofen mit geteilter Mehrfachheizzone
Andere fragen auch
- Warum ist eine hochreine Sauerstoffatmosphäre in einem Atmosphärenofen während der Kalzinierungsphase von Magnesium-Aluminium-Spinell (MgAl2O4)-Pulver notwendig?
- Was bewirkt Stickstoff in einem Ofen? Kontrollieren Sie Ihre Atmosphäre, um Oxidation zu verhindern und Qualität zu gewährleisten
- Was ist ein Schutzgasofen? Reinheit und Präzision bei der Hochtemperaturverarbeitung erreichen
- Was sind die Faktoren, die den Wärmebehandlungsprozess beeinflussen? Meistertemperatur, Zeit, Abkühlung & Atmosphäre
- Warum wird hochreines Argon für die Verarbeitung von 12Kh18N10T-Stahl benötigt? Schützen Sie Ihre Oberflächenintegrität und Datenzuverlässigkeit
- Was ist Ofenatmosphäre? Ein Leitfaden für kontrolliertes Erhitzen für überlegene Ergebnisse
- Wie trägt ein Sinterofen mit Schutzgasatmosphäre zur Herstellung von LAGP-NCNT-Komposit-Luftkathoden bei?
- Was ist eine inerte Atmosphäre? Schützen Sie Materialien und verbessern Sie die Qualität mit kontrollierten Umgebungen



















