Die für die Kalzinierung erforderliche Wärme ist kein einzelner, universeller Wert. Es handelt sich um eine variable Größe, die vollständig vom spezifischen Material, das verarbeitet wird, der zugrunde liegenden chemischen Reaktion und der Effizienz der verwendeten Ausrüstung, wie einem Ofen oder Kalzinator, abhängt. Die Berechnung dieses Wertes erfordert das Verständnis sowohl chemischer Prinzipien als auch realer Systemineffizienzen.
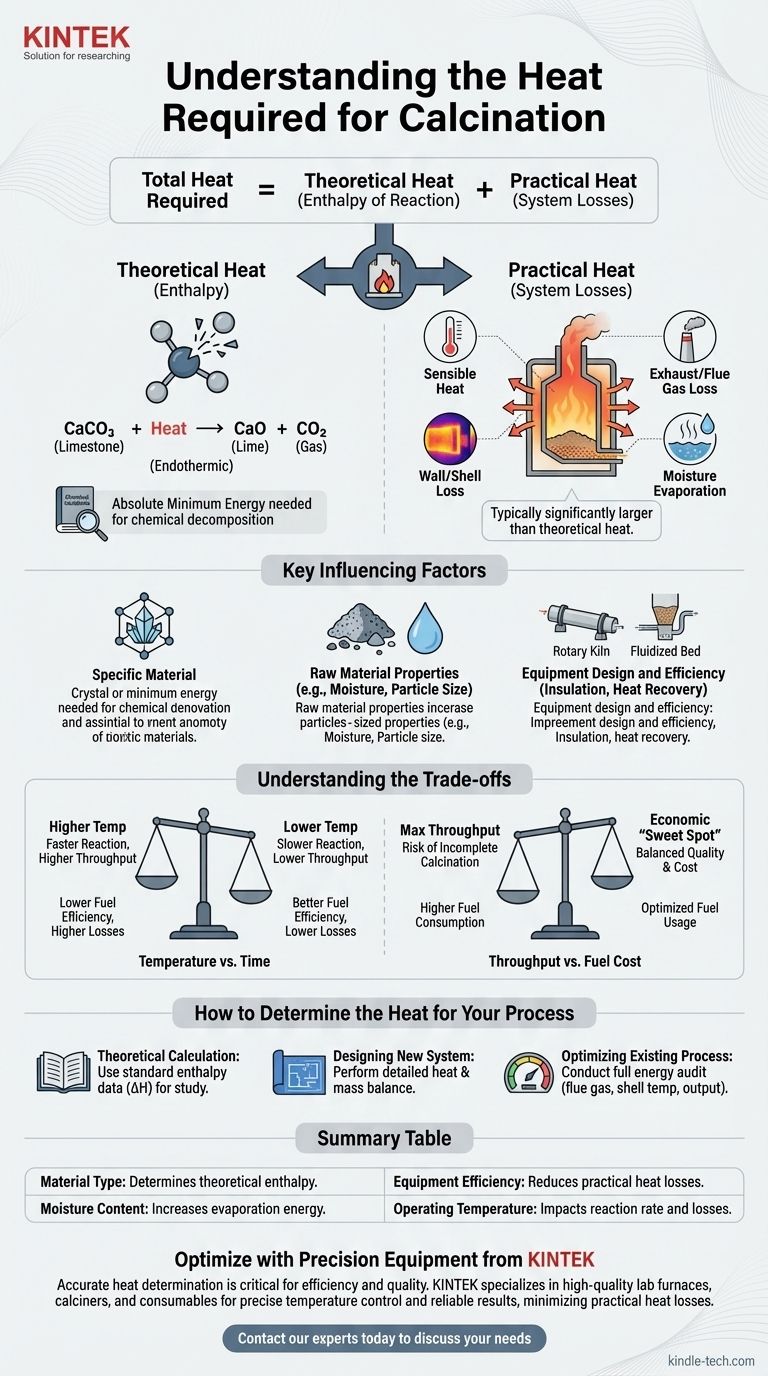
Die für jeden Kalzinierungsprozess erforderliche Gesamtwärme ist die Summe von zwei verschiedenen Komponenten: der theoretischen Reaktionswärme, die zur Aufspaltung der chemischen Bindungen des Materials erforderlich ist, und den praktischen Wärmeverlusten, die dem Betriebssystem innewohnen. Eine erfolgreiche Analyse muss beide berücksichtigen.

Die beiden Komponenten der Kalzinierungswärme
Um den Energiebedarf der Kalzinierung zu verstehen, müssen wir das theoretische Minimum von den praktischen Realitäten industrieller Anlagen trennen.
Theoretische Wärme (Reaktionsenthalpie)
Dies ist die absolute Mindestenergiemenge, die durch die Gesetze der Chemie erforderlich ist, um die Zersetzungsreaktion anzutreiben.
Dieser Wert ist für eine bestimmte chemische Umwandlung festgelegt. Beispielsweise ist die Kalzinierung von Kalkstein (Calciumcarbonat, CaCO₃) zur Herstellung von Kalk (Calciumoxid, CaO) und Kohlendioxid (CO₂) eine endotherme Reaktion, was bedeutet, dass sie eine bestimmte Energiemenge aufnehmen muss, um abzulaufen.
Dieser theoretische Energiebedarf kann für die gängigsten Materialien berechnet oder in Handbüchern für chemische Verfahrenstechnik nachgeschlagen werden.
Praktische Wärme (Systemverluste)
Dies ist all die zusätzliche Energie, die einem realen System über das theoretische Minimum hinaus zugeführt werden muss. Bei den meisten industriellen Prozessen ist diese Komponente erheblich größer als die theoretische Reaktionswärme.
Zu den Hauptquellen für praktische Wärmeverluste gehören:
- Sensible Wärme: Energie, die benötigt wird, um das Material selbst auf die erforderliche Reaktionstemperatur zu erhitzen.
- Abgas-/Rauchgasverluste: Wärme, die von den heißen Gasen abgeführt wird, die den Kalzinator verlassen.
- Wand-/Mantelverluste: Wärme, die von den Außenflächen des Ofens oder Kilns abstrahlt und konvektiert.
- Feuchtigkeitsverdampfung: Energie, die verbraucht wird, um jegliches im Rohmaterial vorhandene Wasser in Dampf umzuwandeln, bevor die Kalzinierungsreaktion überhaupt beginnen kann.
Wichtige Faktoren, die den Wärmebedarf beeinflussen
Die endgültige Energieverbrauchsgröße ist das Ergebnis mehrerer interagierender Variablen. Das Verständnis dieser Faktoren ist entscheidend für die Prozessgestaltung und -optimierung.
Das spezifische Material
Unterschiedliche Materialien weisen sehr unterschiedliche chemische Bindungen und Zersetzungstemperaturen auf. Die Energie, die benötigt wird, um Wasser aus Gips auszutreiben, ist viel geringer als die Energie, die zur Zersetzung von Calciumcarbonat benötigt wird.
Eigenschaften des Rohmaterials
Der physikalische Zustand des Materials spielt eine Rolle. Feine Pulver erwärmen sich gleichmäßiger als große Brocken, und ein hoher anfänglicher Feuchtigkeitsgehalt kann den Energieverbrauch aufgrund der hohen Verdampfungswärme von Wasser dramatisch erhöhen.
Konstruktion und Effizienz der Anlage
Die Art der verwendeten Anlage, wie ein Drehrohrofen, ein Schachtofen oder ein Wirbelschichtkalzinator, hat einen enormen Einfluss auf den Wärmeaustausch.
Faktoren wie die Qualität der Isolierung, die Wirksamkeit von Luftdichtungen und das Vorhandensein von Wärmerückgewinnungssystemen (wie Vorwärmer, die heiße Abgase nutzen, um das einströmende Material vorzuwärmen) sind die Haupttreiber der Gesamtwärmeeffizienz.
Verständnis der Kompromisse
Die Optimierung eines Kalzinierungsprozesses beinhaltet das Abwägen konkurrierender betrieblicher Ziele. Das Ignorieren dieser Kompromisse führt oft zu Ineffizienz oder schlechter Produktqualität.
Temperatur vs. Zeit
Höhere Betriebstemperaturen können die Kalzinierungsreaktion beschleunigen und den Durchsatz erhöhen. Dies führt jedoch oft zu größeren Wärmeverlusten durch den Mantel der Anlage und die Rauchgase, was die Kraftstoffeffizienz verringert.
Umgekehrt spart eine niedrigere Temperatur Energie, erfordert aber, dass das Material länger im Kalzinator verbleibt, was die Produktionsrate begrenzen kann.
Durchsatz vs. Treibstoffkosten
Das Streben nach maximaler Produktionsleistung kann zu einer unvollständigen Kalzinierung führen oder erfordern, dass so viel Brennstoff in das System gepresst wird, dass die Gesamteffizienz stark sinkt.
Das Finden des wirtschaftlichen „Sweet Spots“ erfordert eine sorgfältige Abwägung des Werts des Endprodukts gegen die Kosten des pro Tonne verbrauchten Brennstoffs.
So bestimmen Sie die Wärme für Ihren Prozess
Es gibt keine einzelne Formel, aber Sie können den Wärmebedarf bestimmen, indem Sie sich auf Ihr spezifisches Ziel konzentrieren.
- Wenn Ihr Hauptaugenmerk auf einer theoretischen Berechnung für das Studium liegt: Ermitteln Sie die Standard-Reaktionsenthalpie (ΔH) für Ihre spezifische chemische Zersetzung in einer thermodynamischen Datenreferenz.
- Wenn Ihr Hauptaugenmerk auf der Konstruktion eines neuen Systems liegt: Sie müssen eine detaillierte Wärme- und Stoffbilanz durchführen, die Materialeigenschaften, Anlagenspezifikationen und alle potenziellen Wärmeverluste berücksichtigt.
- Wenn Ihr Hauptaugenmerk auf der Optimierung eines bestehenden Prozesses liegt: Führen Sie eine vollständige Energieprüfung Ihrer Anlage durch und messen Sie Rauchgastemperaturen, Produktleistung und Manteltemperaturen, um die Hauptquellen für Wärmeverluste zu identifizieren und zu quantifizieren.
Letztendlich geht die genaue Bestimmung der Kalzinierungswärme über eine einzelne Zahl hinaus und erfordert eine umfassende Analyse Ihres spezifischen Materials und Systems.
Zusammenfassungstabelle:
| Faktor | Auswirkung auf den Wärmebedarf |
|---|---|
| Materialtyp | Bestimmt die theoretische Reaktionsenthalpie (z. B. Kalkstein vs. Gips). |
| Feuchtigkeitsgehalt | Hohe Feuchtigkeit erhöht den Energiebedarf für die Verdampfung erheblich. |
| Anlageneffizienz | Bessere Isolierung und Wärmerückgewinnungssysteme reduzieren die praktischen Wärmeverluste. |
| Betriebstemperatur | Höhere Temperaturen können die Reaktionsgeschwindigkeit erhöhen, aber auch die Wärmeverluste. |
Optimieren Sie Ihren Kalzinierungsprozess mit Präzisionsanlagen von KINTEK.
Die genaue Bestimmung des Wärmebedarfs ist entscheidend für Effizienz und Produktqualität. Ob Sie ein neues System entwerfen oder ein bestehendes optimieren, die richtige Laborausrüstung ist für eine genaue thermische Analyse und Materialprüfung unerlässlich.
KINTEK ist spezialisiert auf hochwertige Laboröfen, Kalzinatoren und Verbrauchsmaterialien, die die präzise Temperaturkontrolle und Zuverlässigkeit bieten, die für Ihre Forschung und Prozessentwicklung erforderlich sind. Unsere Lösungen helfen Ihnen, praktische Wärmeverluste zu minimieren und optimale Ergebnisse zu erzielen.
Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Kalzinierungsanforderungen zu besprechen und herauszufinden, wie KINTEK die Fähigkeiten Ihres Labors verbessern kann.
Visuelle Anleitung
Ähnliche Produkte
- 1800℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1400℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Wie lauten die Prozessbedingungen bei der schnellen Pyrolyse? Maximierung der Bioöl-Ausbeute durch präzise Steuerung
- Was ist Sicherheit im Pyrolyseprozess? Umgang mit extremer Hitze und brennbaren Produkten
- Wie ist Pyrolyse nachhaltig? Abfall in Energie und Kreislaufmaterialien umwandeln
- Was ist besser, Pyrolyse oder Vergasung? Wählen Sie den richtigen Prozess für Ihre Energiezielen
- Welchen Brennstoff verwendet ein Drehrohrofen? Maximieren Sie die Prozesseffizienz mit vielseitigen Brennstoffoptionen
- Welche Parameter beeinflussen die Pyrolyse? Beherrschen Sie die 4 wichtigsten Stellschrauben für optimale Ergebnisse
- Was ist der beste Rohstoff für Biokohle? Passen Sie Ihr Material an Ihr Ziel an, um maximale Wirkung zu erzielen
- Was ist die Pyrolysemethode für Kunststoffabfälle? Umwandlung nicht recycelbarer Kunststoffe in Kraftstoff



















