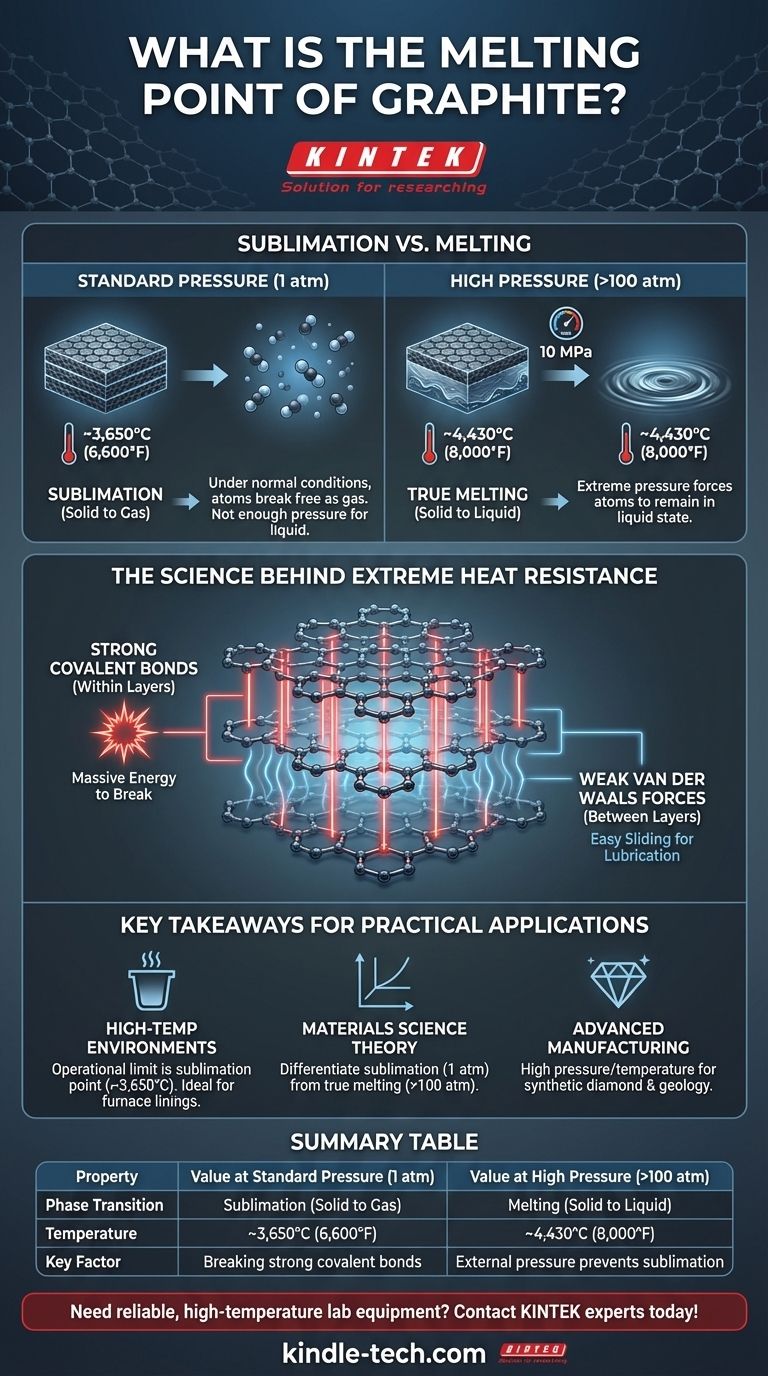
Unter normalen Bedingungen schmilzt Graphit nicht. Anstatt flüssig zu werden, sublimiert es – es geht direkt vom festen in den gasförmigen Zustand über – bei etwa 3.650 °C (6.600 °F). Eine echte Schmelze tritt nur unter extremem Druck auf, der die Kohlenstoffatome zwingt, bei einer viel höheren Temperatur in einem flüssigen Zustand zu verbleiben.
Die immense thermische Stabilität von Graphit ist kein Zufall seiner Zusammensetzung, sondern eine direkte Folge seiner Atomstruktur. Die außergewöhnlich starken kovalenten Bindungen, die die Kohlenstoffatome in Schichten zusammenhalten, erfordern eine enorme Energiemenge, um sie zu brechen, was zu einem der höchsten Sublimationspunkte aller Elemente führt.

Die Wissenschaft hinter der extremen Hitzebeständigkeit von Graphit
Um zu verstehen, warum Graphit so hitzebeständig ist, müssen wir uns ansehen, wie seine Kohlenstoffatome angeordnet und miteinander verbunden sind.
Die Kraft kovalenter Bindungen
Graphit ist ein Allotrop des Kohlenstoffs, was bedeutet, dass es eine von mehreren physikalischen Formen ist, die das Element annehmen kann. Seine Struktur besteht aus flachen, zweidimensionalen Ebenen von Kohlenstoffatomen, die in einem hexagonalen Gitter angeordnet sind.
Innerhalb jeder dieser Ebenen (eine einzelne Schicht wird als Graphen bezeichnet) ist jedes Kohlenstoffatom durch extrem starke kovalente Bindungen mit drei anderen verbunden. Diese Bindungen verleihen Graphit seine unglaubliche thermische Stabilität. Um sie zu brechen, ist eine enorme Energiemenge erforderlich, was sich direkt in einer sehr hohen Temperatur niederschlägt.
Schichten vs. Bindungen: Ein wichtiger Unterschied
Ein häufiger Irrtum ist die Verwendung von Graphit als Schmiermittel. Wenn es so stark ist, warum ist es dann auch rutschig?
Die Antwort liegt im Unterschied zwischen den Kräften innerhalb der Schichten und den Kräften zwischen ihnen. Während die kovalenten Bindungen innerhalb jedes Graphenblattes stark sind, sind die Bindungen, die die einzelnen Schichten zusammenhalten, sehr schwache Van-der-Waals-Kräfte.
Diese schwachen interschichtigen Kräfte ermöglichen es den Ebenen, leicht aneinander vorbeizugleiten, was den Schmiereffekt von Graphit erzeugt. Das Schmelzen oder Sublimieren des Materials erfordert jedoch das Brechen der starken kovalenten Bindungen innerhalb der Schichten, nicht der schwachen Bindungen dazwischen.
Schmelzen vs. Sublimation: Eine kritische Unterscheidung
Die Begriffe „Schmelzpunkt“ und „Sublimationspunkt“ werden bei Graphit oft synonym verwendet, beschreiben jedoch unterschiedliche physikalische Phänomene, die unter sehr unterschiedlichen Bedingungen auftreten.
Sublimation bei Normaldruck
Bei normalem atmosphärischem Druck (1 atm) reicht die Kraft nicht aus, um die Kohlenstoffatome in einer flüssigen Phase zusammenzuhalten, während sie Energie durch Wärme aufnehmen.
Anstatt dass sich die Bindungen so weit lockern, dass sich eine Flüssigkeit bildet, nehmen die Atome so viel Energie auf, dass sie sich vollständig von der festen Struktur lösen und als Gas entweichen. Dieser direkte Übergang von fest zu gasförmig ist die Sublimation.
Echtes Schmelzen bei hohem Druck
Um Graphit zum Schmelzen zu zwingen, muss enormer Druck ausgeübt werden. Der Tripelpunkt von Kohlenstoff – der spezifische Zustand, in dem Feststoff, Flüssigkeit und Gas koexistieren können – tritt bei einem Druck von etwa 10 Megapascal (MPa) auf, oder etwa dem 100-fachen des normalen atmosphärischen Drucks.
Unter diesen Bedingungen verhindert der äußere Druck, dass die Kohlenstoffatome als Gas entweichen. Stattdessen gehen sie bei einer Temperatur von etwa 4.430 °C (8.000 °F) in einen flüssigen Zustand über. Dies ist der wahre Schmelzpunkt von Graphit.
Wichtige Erkenntnisse für praktische Anwendungen
Ihr Verständnis des Verhaltens von Graphit bei hohen Temperaturen beeinflusst direkt seine Verwendung in Wissenschaft und Industrie.
- Wenn Ihr Hauptaugenmerk auf Hochtemperaturanwendungen liegt (z. B. Tiegel, Ofenauskleidungen): Verlassen Sie sich auf den Sublimationspunkt von Graphit als Betriebsgrenze, da das Schmelzen unter normalen Drücken keine Rolle spielt.
- Wenn Ihr Hauptaugenmerk auf Materialwissenschaftstheorie liegt: Unterscheiden Sie klar zwischen dem Sublimationspunkt (bei 1 atm) und dem tatsächlichen Schmelzpunkt (bei >100 atm), um das Phasendiagramm von Kohlenstoff genau zu beschreiben.
- Wenn Ihr Hauptaugenmerk auf fortgeschrittener Fertigung oder Geologie liegt: Der hohe Druck und die hohe Temperatur, die für flüssigen Kohlenstoff erforderlich sind, sind relevant für das Verständnis von Prozessen wie der Synthese von Diamanten und den Bedingungen tief im Erdmantel.
Letztendlich ist die Widerstandsfähigkeit von Graphit eine direkte Widerspiegelung der leistungsstarken kovalenten Bindungen, die den grundlegenden Baustein seiner Struktur bilden.
Zusammenfassungstabelle:
| Eigenschaft | Wert bei Normaldruck (1 atm) | Wert bei hohem Druck (>100 atm) |
|---|---|---|
| Phasenübergang | Sublimation (Fest zu Gas) | Schmelzen (Fest zu Flüssig) |
| Temperatur | ~3.650°C (6.600°F) | ~4.430°C (8.000°F) |
| Schlüsselfaktor | Brechen starker kovalenter Bindungen in Graphenschichten | Äußerer Druck verhindert Sublimation |
Benötigen Sie zuverlässige Laborgeräte für hohe Temperaturen? Die außergewöhnliche thermische Stabilität von Graphit macht es ideal für Ofenauskleidungen, Tiegel und Hochtemperaturanwendungen. Bei KINTEK sind wir auf erstklassige Laborgeräte und Verbrauchsmaterialien spezialisiert und liefern die langlebigen Werkzeuge, die Ihr Labor benötigt, um bei extremen Temperaturen sicher und effizient zu arbeiten. Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für Ihre Hochtemperaturanforderungen zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Graphitierungs-Vakuumofen für ultrahohe Temperaturen
- Graphit-Vakuumofen Hochwärmeleitfähige Folien-Graphitierungsöfen
- Graphit-Vakuum-Durchlaufgraphitierungsöfen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Wofür wird der Graphitofen verwendet? Erreichen Sie extreme Hitze bis zu 3000°C in einer kontrollierten Umgebung
- Wird Graphit als feuerfestes Material verwendet? Entdecken Sie seine unübertroffene Hochtemperaturleistung
- Wie viel Temperatur kann Graphit aushalten? Entdecken Sie sein wahres Potenzial bis zu 3000°C
- Wird Graphit durch Hitze beeinflusst? Entdecken Sie seine bemerkenswerte Festigkeit und Stabilität bei hohen Temperaturen
- Bei welcher Temperatur zersetzt sich Graphit thermisch? Die kritische Rolle der Atmosphäre



















