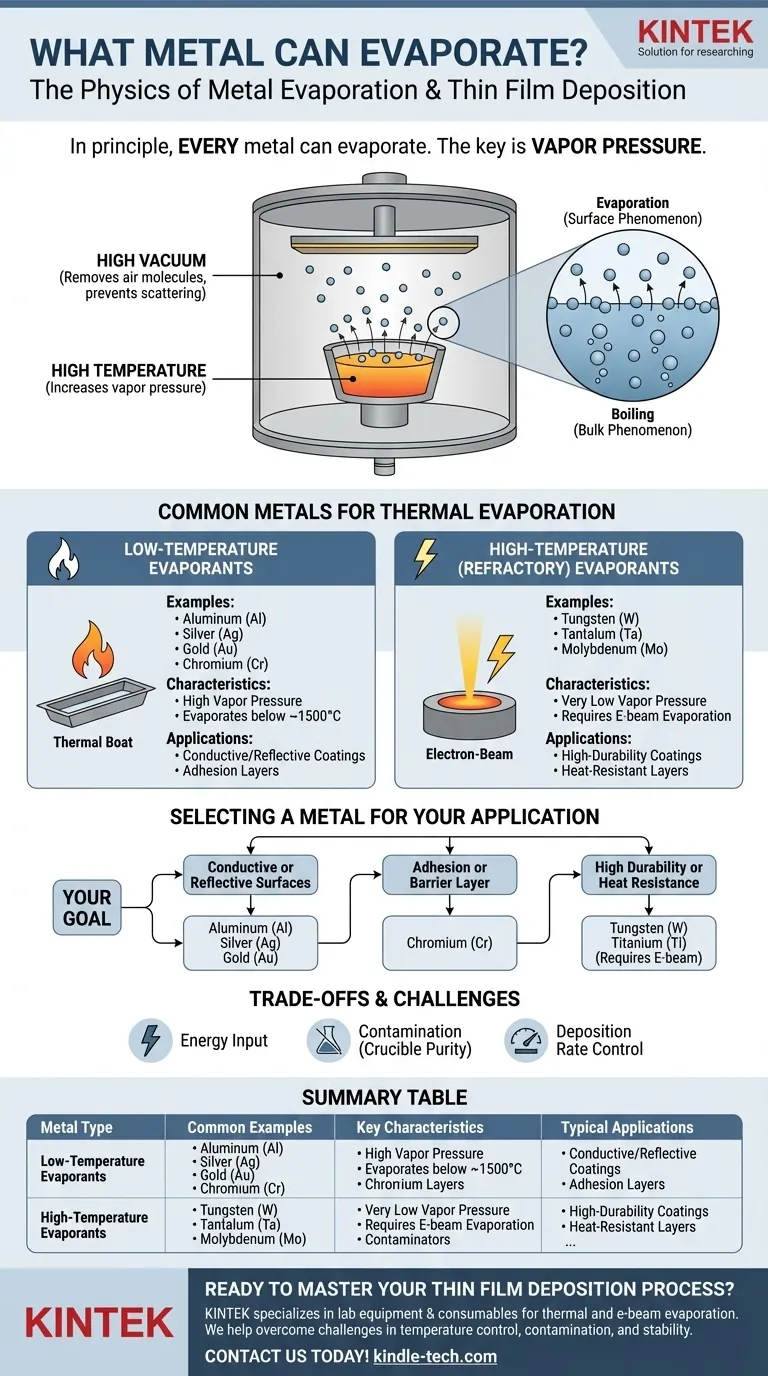
Grundsätzlich kann jedes Metall verdampfen. Verdampfung ist ein physikalischer Prozess, bei dem ein Element oder eine Verbindung von einer flüssigen oder festen Phase in eine Gasphase übergeht. Bei Metallen wird dieser Prozess durch Temperatur und Druck gesteuert. Gängige Beispiele in technischen Anwendungen sind die thermische Verdampfung von Gold (Au), Chrom (Cr) und Germanium (Ge) zur Herstellung von Dünnschichten.
Die Kernfrage ist nicht, ob ein Metall verdampfen kann, sondern wie leicht es dies tut. Dies wird durch den intrinsischen Dampfdruck des Metalls bestimmt – ein Maß für seine Tendenz, bei einer gegebenen Temperatur gasförmig zu werden. Metalle mit höherem Dampfdruck lassen sich viel leichter verdampfen.

Die Physik der Metallverdampfung
Um zu verstehen, welche Metalle für die Verdampfung praktikabel sind, müssen Sie zunächst die Prinzipien verstehen, die diesen Prozess steuern. Es ist ein Gleichgewicht zwischen den Eigenschaften des Materials und der von Ihnen geschaffenen Umgebung.
Was ist Dampfdruck?
Der Dampfdruck ist der Druck, den ein Dampf im Gleichgewicht mit seiner festen oder flüssigen Phase ausübt. Jedes Material hat einen Dampfdruck, und dieser nimmt mit steigender Temperatur erheblich zu.
Ein Metall mit hohem Dampfdruck verdampft bei einer bestimmten Temperatur viel schneller als ein Metall mit niedrigem Dampfdruck. Dies ist die wichtigste Eigenschaft, die seine Eignung für die Verdampfung bestimmt.
Die Rolle von Temperatur und Vakuum
Um eine nützliche Verdampfungsrate für die meisten Metalle zu erreichen, benötigen Sie sehr hohe Temperaturen, oft Hunderte oder Tausende von Grad Celsius.
Dieser Prozess wird fast immer in einer Hochvakuumanlage durchgeführt. Das Vakuum entfernt Luftmoleküle, die sonst mit den verdampfenden Metallatomen kollidieren, sie streuen und verhindern würden, dass sie ihr Zielsubstrat erreichen.
Verdampfung vs. Sieden
Verdampfung ist ein Oberflächenphänomen, bei dem einzelne Atome genügend Energie gewinnen, um zu entweichen. Sieden ist ein Volumenphänomen, bei dem der Dampfdruck dem umgebenden atmosphärischen Druck entspricht, wodurch sich Blasen im Material bilden.
Bei der Vakuumabscheidung besteht das Ziel darin, eine kontrollierte Verdampfungsrate zu erreichen, nicht das Ausgangsmaterial gewaltsam zum Sieden zu bringen.
Häufig verwendete Metalle bei der thermischen Verdampfung
Metalle werden oft danach kategorisiert, welche Temperaturen für eine effektive Verdampfung im Vakuum erforderlich sind.
Niedertemperatur-Verdampfer
Diese Metalle haben relativ hohe Dampfdrücke und können bei handhabbaren Temperaturen (typischerweise unter 1500 °C) verdampft werden. Sie werden häufig zur Herstellung von Beschichtungen verwendet.
Häufige Beispiele sind Aluminium (Al), Silber (Ag), Gold (Au) und Chrom (Cr). Ihre einfache Handhabung macht sie zu Grundpfeilern in der Elektronik und Optik.
Hochtemperatur-(Feuerfeste) Verdampfer
Feuerfeste Metalle weisen extrem niedrige Dampfdrücke und sehr hohe Schmelzpunkte auf, was ihre Verdampfung mit einfachen thermischen Methoden erschwert.
Metalle wie Wolfram (W), Tantal (Ta) und Molybdän (Mo) erfordern spezielle Techniken, wie die Elektronenstrahlverdampfung, die die benötigten viel höheren lokalen Temperaturen erreichen kann.
Die Abwägungen verstehen
Es reicht nicht aus, einfach ein Metall auszuwählen; Sie müssen die praktischen Herausforderungen und Einschränkungen des Verdampfungsprozesses verstehen.
Die Herausforderung feuerfester Metalle
Die Verdampfung eines Metalls wie Wolfram erfordert einen immensen Energieaufwand. Die Ausrüstung ist komplexer und teurer, da sie extreme Temperaturen erzeugen und aushalten muss, ohne den Prozess zu kontaminieren.
Quellreinheit und Kontamination
Das Material des Tiegels oder „Töpfchens“, das das Metall hält, kann ebenfalls eine Kontaminationsquelle sein. Bei hohen Temperaturen kann das Tiegelmaterial selbst verdampfen oder mit dem geschmolzenen Metall reagieren, wodurch Verunreinigungen in Ihre endgültige Dünnschicht gelangen.
Abscheidungsrate und Kontrolle
Die Verdampfungsrate eines Metalls kann sich bei kleinen Temperaturschwankungen dramatisch ändern. Die Aufrechterhaltung eines stabilen, reproduzierbaren Abscheidungsprozesses erfordert eine hochpräzise Temperaturregelung, was bei Niedertemperaturmaterialien einfacher ist als bei feuerfesten Metallen.
Auswahl eines Metalls für Ihre Anwendung
Ihre Wahl des Metalls sollte vollständig vom Ziel der von Ihnen erstellten Dünnschicht bestimmt werden.
- Wenn Ihr Hauptaugenmerk auf der Herstellung leitfähiger oder reflektierender Oberflächen liegt: Metalle wie Aluminium (Al), Silber (Ag) und Gold (Au) sind aufgrund ihrer hohen Leitfähigkeit/Reflexion und relativ einfachen Verdampfung ausgezeichnete Wahlmöglichkeiten.
- Wenn Ihr Hauptaugenmerk auf einer Haft- oder Sperrschicht liegt: Chrom (Cr) ist eine Standardwahl, da es gut auf vielen Substraten wie Glas haftet und somit eine hervorragende Zwischenschicht für nachfolgende Abscheidungen darstellt.
- Wenn Ihr Hauptaugenmerk auf hoher Haltbarkeit oder Hitzebeständigkeit liegt: Sie müssen ein feuerfestes Metall wie Wolfram (W) oder Titan (Ti) verwenden, müssen sich jedoch auf einen komplexeren und energieintensiveren Elektronenstrahl-Verdampfungsprozess einstellen.
Letztendlich ist das Verständnis des Dampfdrucks eines Metalls der Schlüssel zur Beherrschung seiner Verdampfung für jede technische Anwendung.
Zusammenfassungstabelle:
| Metalltyp | Häufige Beispiele | Schlüsselmerkmale | Typische Anwendungen |
|---|---|---|---|
| Niedertemperatur-Verdampfer | Aluminium (Al), Gold (Au), Silber (Ag), Chrom (Cr) | Hoher Dampfdruck, verdampft unterhalb von ~1500°C | Leitfähige Beschichtungen, reflektierende Oberflächen, Haftschichten |
| Hochtemperatur-(Feuerfeste) Verdampfer | Wolfram (W), Tantal (Ta), Molybdän (Mo) | Sehr niedriger Dampfdruck, erfordert Elektronenstrahlverdampfung | Hochbeständige Beschichtungen, hitzebeständige Schichten |
Bereit, Ihren Dünnschichtabscheidungsprozess zu meistern?
Die Wahl des richtigen Metalls und der richtigen Verdampfungstechnik ist entscheidend für die Erzielung hochwertiger, konsistenter Ergebnisse. KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien für die thermische Verdampfung und Elektronenstrahlverdampfung und bietet die präzisen Werkzeuge und die fachkundige Unterstützung, die Sie benötigen.
Wir helfen unseren Kunden in Forschung und Entwicklung sowie in der Fertigung, Herausforderungen wie Temperaturkontrolle, Kontamination und Stabilität der Abscheidungsrate zu meistern. Kontaktieren Sie uns noch heute, um Ihre spezifische Anwendung zu besprechen, und lassen Sie sich von unseren Experten zur optimalen Lösung für die Bedürfnisse Ihres Labors beraten.
Kontaktieren Sie uns über unser Kontaktformular
Visuelle Anleitung
Ähnliche Produkte
- Chemische Gasphasenabscheidung CVD-Anlagenkammer-Schiebe-PECVD-Rohröfen mit Flüssiggasifikator PECVD-Maschine
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Geteilter Kammer-CVD-Röhrenofen mit Vakuumpumpe, Anlage für chemische Gasphasenabscheidung
- RF PECVD System Hochfrequenz-Plasma-unterstützte chemische Gasphasenabscheidung RF PECVD
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
Andere fragen auch
- Was sind Abscheidungsmethoden? Ein Leitfaden zu PVD- und CVD-Dünnschichttechniken
- Wie werden Dünnschichten abgeschieden? Ein Leitfaden zu PVD- vs. CVD-Methoden für Ihre Anwendung
- Welche Farbe haben CVD-Diamanten? Einblicke in den Prozess von Braun-Stich bis farbloser Schönheit
- Was ist der Prozess der Vakuumbeschichtung? Beherrschung der CVD- und PVD-Dünnschichtbeschichtung
- Was sind die verschiedenen Arten von Dünnschichten? Ein Leitfaden für optische, elektrische und funktionale Beschichtungen



















