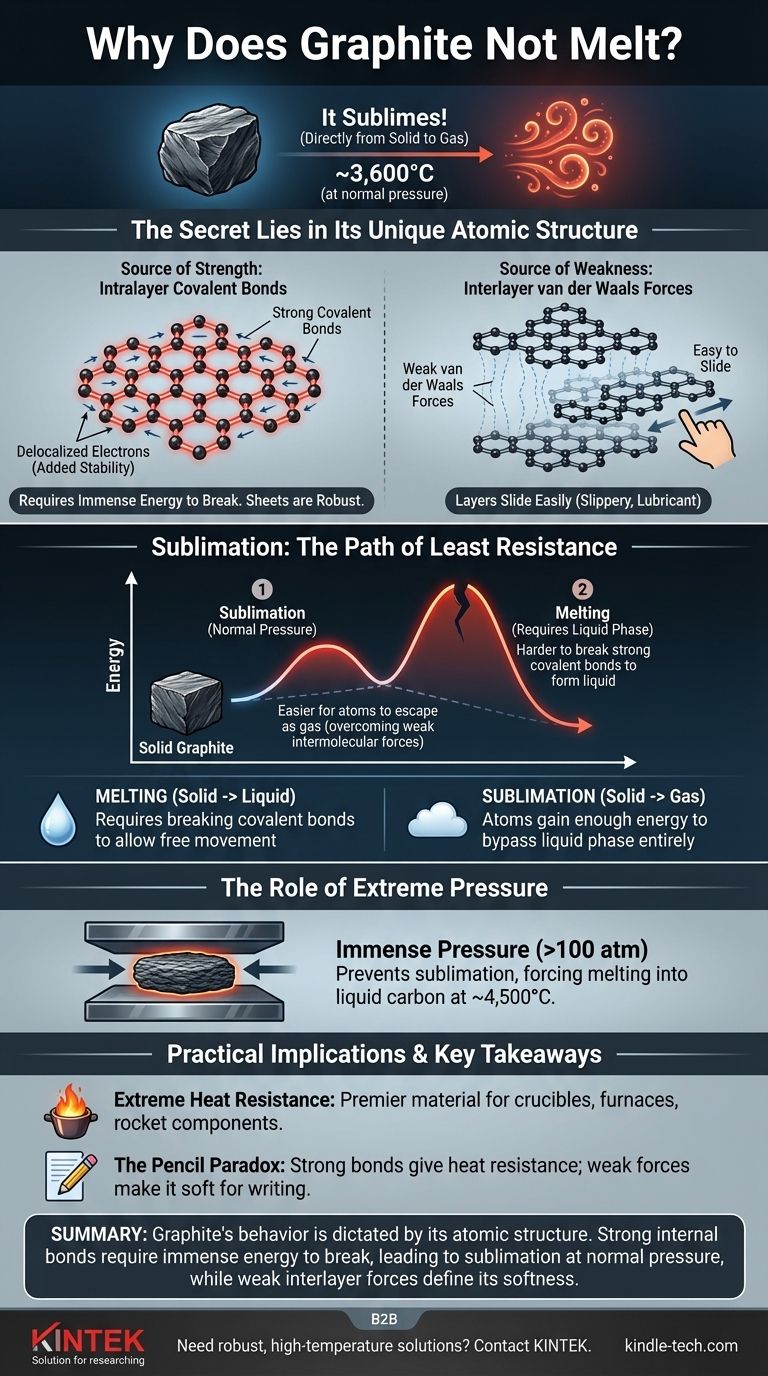
Es ist ein weit verbreitetes Missverständnis, dass Graphit nicht schmilzt. Unter normalem atmosphärischem Druck tut Graphit etwas anderes: Es sublimiert, d.h. es geht bei einer unglaublich hohen Temperatur von etwa 3.600°C (6.500°F) direkt vom festen in den gasförmigen Zustand über. Dieses Verhalten ist eine direkte Folge der immensen Stärke der chemischen Bindungen, die seine Kohlenstoffatome zusammenhalten.
Der Hauptgrund für die extreme Hitzebeständigkeit von Graphit ist seine einzigartige atomare Struktur. Es besteht aus Schichten von Kohlenstoffatomen, die durch außergewöhnlich starke kovalente Bindungen verbunden sind, deren Aufbrechen eine enorme Energiemenge erfordert, damit die Substanz ihren Zustand ändern kann.

Die atomare Struktur von Graphit entschlüsseln
Um zu verstehen, warum Graphit sich so verhält, müssen wir uns ansehen, wie seine Kohlenstoffatome angeordnet sind. Seine Struktur wird durch zwei sehr unterschiedliche Arten von chemischen Bindungen definiert, die gleichzeitig wirken.
Die Quelle der Stärke: Kovalente Bindungen innerhalb der Schichten
Graphit besteht aus flachen, zweidimensionalen Schichten von Kohlenstoffatomen, die in einem hexagonalen, wabenartigen Gitter angeordnet sind.
Innerhalb jeder Schicht ist jedes Kohlenstoffatom durch starke kovalente Bindungen mit drei anderen verbunden. Diese gehören zu den stärksten chemischen Bindungen in der Natur.
Darüber hinaus wird ein Elektron von jedem Kohlenstoffatom delokalisiert, was bedeutet, dass es sich frei über die gesamte Schicht bewegen kann. Diese gemeinsame Nutzung von Elektronen unter allen Atomen in der Schicht fügt eine signifikante Stabilität hinzu und stärkt die Bindungen weiter, wodurch die Schichten unglaublich robust und schwer zu trennen sind.
Die Quelle der Schwäche: Kräfte zwischen den Schichten
Während die Atome innerhalb einer Schicht stark gebunden sind, werden die Schichten selbst durch viel schwächere Kräfte, bekannt als Van-der-Waals-Kräfte, zusammengehalten.
Diese Kräfte sind schwach genug, dass die Schichten leicht aneinander vorbeigleiten können. Deshalb fühlt sich Graphit rutschig an und wird als Schmiermittel und in Bleistiften verwendet – beim Schreiben bleiben Graphitschichten auf dem Papier zurück.
Sublimation: Der Weg des geringsten Widerstands
Der extreme Unterschied zwischen den starken Bindungen innerhalb der Schichten und den schwachen Kräften zwischen ihnen bestimmt, wie Graphit auf Hitze reagiert.
Schmelzen vs. Sublimieren
Schmelzen ist der Prozess, bei dem ein Feststoff zu einer Flüssigkeit wird. Damit dies geschieht, müssen die Atome genug Energie gewinnen, um sich von ihren festen Positionen zu lösen, aber immer noch voneinander angezogen zu werden.
Sublimation ist der direkte Übergang von einem Feststoff in ein Gas. In diesem Fall gewinnen die Atome so viel Energie, dass sie die flüssige Phase vollständig umgehen und in die Luft entweichen.
Warum Sublimation bei normalem Druck gewinnt
Bei Standardatmosphärendruck ist die Energie, die zum Brechen der starken kovalenten Bindungen innerhalb der Graphitschichten erforderlich ist, immens.
Bevor die Struktur genug Energie aufnehmen kann, um zu einer Flüssigkeit zu schmelzen, gewinnen die Atome an der Oberfläche genug Energie, um die schwachen intermolekularen Kräfte zu überwinden und einfach als Gas zu entweichen. Es ist energetisch einfacher für die Atome, direkt in einen gasförmigen Zustand zu entweichen, als die kovalenten Bindungen zu brechen, die zur Bildung einer Flüssigkeit erforderlich wären.
Die Rolle von extremem Druck
Graphit kann zum Schmelzen gebracht werden, aber nur unter außergewöhnlichen Bedingungen.
Durch die Anwendung von immensem Druck (über das 100-fache des normalen atmosphärischen Drucks) kann man verhindern, dass die Kohlenstoffatome als Gas entweichen. Unter diesen Bedingungen schmilzt Graphit bei einer Temperatur von etwa 4.500°C (8.132°F) zu flüssigem Kohlenstoff.
Die praktischen Auswirkungen dieser Struktur
Diese einzigartige Doppelbindungsstruktur verleiht Graphit eine Reihe von Eigenschaften, die widersprüchlich erscheinen, aber für seine industriellen Anwendungen unerlässlich sind.
Extreme Hitzebeständigkeit
Der hohe Sublimationspunkt macht Graphit zu einem erstklassigen Material für Hochtemperaturumgebungen. Es wird zur Herstellung von Tiegeln zum Schmelzen von Metallen, Auskleidungen für Öfen und Komponenten in Raketentriebwerken verwendet, die enormer Hitze standhalten müssen.
Das Bleistift-Paradoxon
Die Struktur von Graphit erklärt, wie es sowohl unglaublich hitzebeständig als auch überraschend weich sein kann. Die Stärke kommt von den kovalenten Bindungen innerhalb der Schichten, während die Weichheit und die schmierenden Eigenschaften von der Leichtigkeit herrühren, mit der diese Schichten übereinander gleiten.
Wichtige Erkenntnisse zum Verständnis von Graphit
- Wenn Ihr Hauptaugenmerk auf seinem Verhalten unter Hitze liegt: Denken Sie daran, dass Graphit bei normalem Druck direkt zu einem Gas sublimiert, da die dafür benötigte Energie geringer ist als die Energie, die zum Brechen der kovalenten Bindungen und zur Bildung einer Flüssigkeit erforderlich wäre.
- Wenn Ihr Hauptaugenmerk auf seinen physikalischen Eigenschaften liegt: Der Schlüssel ist seine Schichtstruktur. Starke Bindungen innerhalb der Schichten sorgen für Hitzebeständigkeit, während schwache Kräfte zwischen den Schichten es weich und zu einem effektiven Schmiermittel machen.
- Wenn Ihr Hauptaugenmerk auf der technischen Definition des Schmelzens liegt: Graphit kann absolut schmelzen, aber nur unter extrem hohem Druck, der verhindert, dass die Atome zuerst sublimieren.
Letztendlich ist das Verhalten von Graphit ein perfektes Beispiel dafür, wie die atomare Struktur eines Materials seine realen Eigenschaften bestimmt.
Zusammenfassungstabelle:
| Eigenschaft | Beschreibung | Hauptgrund |
|---|---|---|
| Sublimationspunkt | ~3.600°C (bei normalem Druck) | Schwache Van-der-Waals-Kräfte zwischen den Schichten ermöglichen es den Atomen, als Gas zu entweichen, bevor sie schmelzen. |
| Schmelzpunkt | ~4.500°C (unter extremem Druck >100 atm) | Hoher Druck verhindert die Sublimation und zwingt die kovalenten Bindungen zum Brechen für das Schmelzen. |
| Hitzebeständigkeit | Hervorragend für Hochtemperaturanwendungen | Extrem starke kovalente Bindungen innerhalb der Kohlenstoffschichten erfordern immense Energie zum Brechen. |
Benötigen Sie robuste Hochtemperaturlösungen für Ihr Labor?
Die einzigartigen Eigenschaften von Graphit machen es zu einem unverzichtbaren Material für anspruchsvolle Anwendungen. Bei KINTEK sind wir spezialisiert auf die Bereitstellung hochwertiger Laborausrüstung und Verbrauchsmaterialien, einschließlich Graphittiegel und Ofenkomponenten, die für extreme Bedingungen ausgelegt sind.
Lassen Sie sich von unseren Experten bei der Auswahl der richtigen Materialien beraten, um die Effizienz und Sicherheit Ihres Labors zu verbessern. Kontaktieren Sie KINTEK noch heute, um Ihre spezifischen Hochtemperaturanforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Graphitierungs-Vakuumofen für ultrahohe Temperaturen
- Graphit-Vakuumofen Hochwärmeleitfähige Folien-Graphitierungsöfen
- Graphit-Vakuum-Durchlaufgraphitierungsöfen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Ist die Pyrolyse von Kunststoff schädlich? Die Wahrheit über toxische Nebenprodukte und Umweltrisiken
- Was sind die industriellen Anwendungen des Schmelzens? Ein Leitfaden zur Materialkontrolle in der Fertigung
- Was sind einige Anwendungsbeispiele, die Ultra-Tiefkühlschränke erfordern? Schützen Sie Ihre wertvollsten Proben
- Wie lange dauert das Sintern? Von Millisekunden bis zu Tagen für optimale Ergebnisse
- Was sind die Fehlerquellen bei der Röntgenfluoreszenzanalyse (RFA)? Master-Probe, Instrument und Methodensteuerung
- Was sind die Herausforderungen bei der Nutzung von Biomasse zur Biokraftstoffproduktion? Überwindung logistischer und technischer Hürden
- Ist Wärmebehandlung nur für Eisenmetalle gut? Beherrschung des Prozesses für Aluminium, Titan & mehr
- Was ist die Bedeutung des Sinterprozesses in der Fertigung? Präzision und Materialhaltbarkeit freisetzen



















