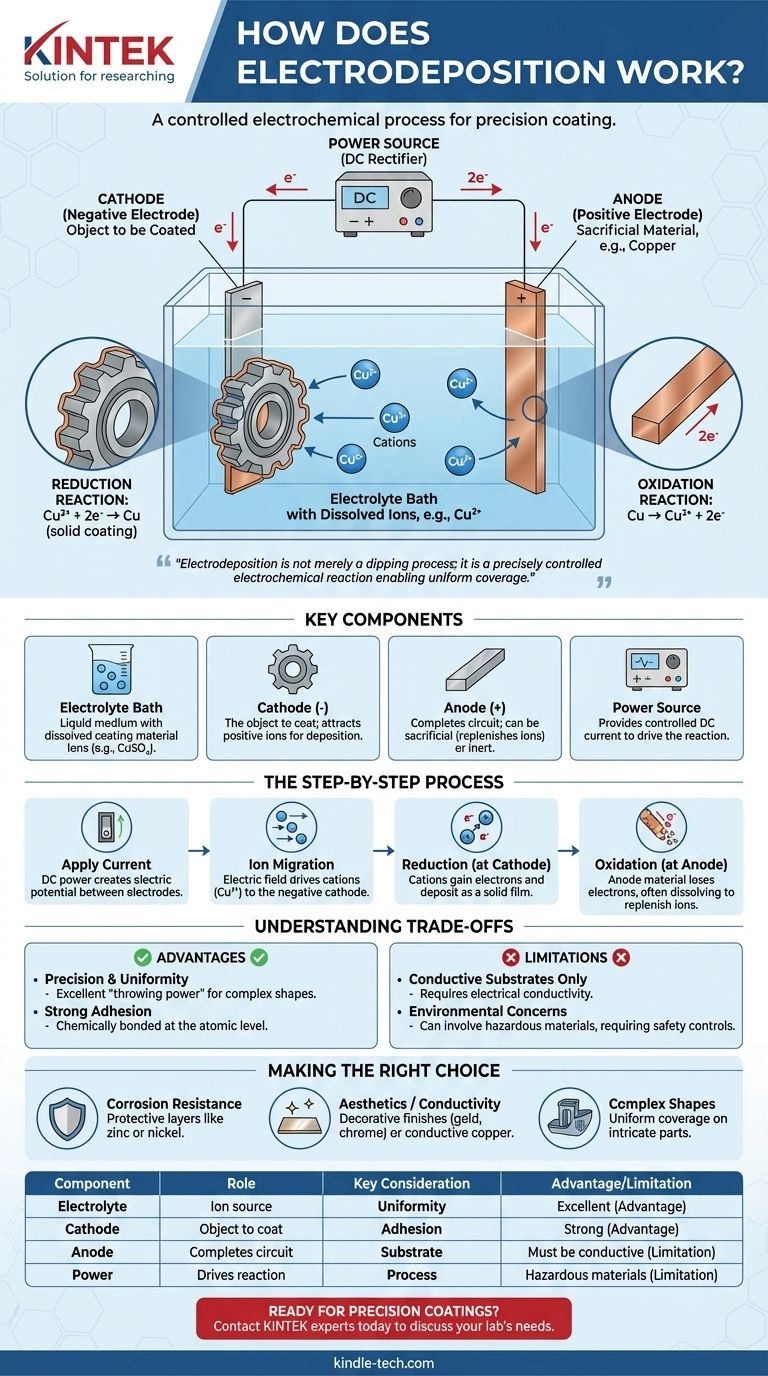
Im Kern ist die Elektroabscheidung ein Prozess, der elektrischen Strom verwendet, um ein leitfähiges Objekt mit einer dünnen Materialschicht zu überziehen. Dies wird erreicht, indem das Objekt (die Kathode) und eine zweite Elektrode (die Anode) in eine chemische Lösung oder ein Elektrolytbad getaucht werden, das gelöste Ionen des Beschichtungsmaterials enthält. Wenn ein Gleichstrom angelegt wird, werden diese Ionen zur Oberfläche des Objekts gezogen, wo sie als Feststoff "abgeschieden" werden, wodurch ein gleichmäßiger und haftender metallischer oder organischer Film entsteht.
Die entscheidende Erkenntnis ist, dass die Elektroabscheidung nicht nur ein Tauchprozess ist; sie ist eine präzise gesteuerte elektrochemische Reaktion. Das elektrische Feld bestimmt, wo und wie die Beschichtung entsteht, was eine gleichmäßige Bedeckung selbst komplexester Formen mit einer Schicht ermöglicht, deren Dicke direkt proportional zum angelegten Strom und zur Zeit ist.

Die Schlüsselkomponenten der Elektroabscheidezelle
Um den Prozess zu verstehen, müssen Sie zunächst seine grundlegenden Komponenten kennen. Jede Elektroabscheideanlage, vom Laborbecherglas bis zum Industrietank, besteht aus vier wesentlichen Teilen, die zusammenwirken.
Das Elektrolytbad
Der Elektrolyt ist das flüssige Medium, das den gesamten Prozess ermöglicht. Es ist eine Lösung, typischerweise auf Wasserbasis, die gelöste Salze des abzuscheidenden Materials enthält. Beim Verkupfern würde das Bad beispielsweise ein Salz wie Kupfersulfat (CuSO₄) enthalten, das die Kupferionen (Cu²⁺) liefert.
Die Kathode (Negative Elektrode)
Dies ist das Objekt, das Sie beschichten möchten. Es ist mit dem negativen Pol der Stromversorgung verbunden. Die negative Ladung auf seiner Oberfläche zieht die positiv geladenen Metallionen aus dem Elektrolytbad an.
Die Anode (Positive Elektrode)
Die Anode ist mit dem positiven Pol der Stromversorgung verbunden und schließt den Stromkreis. Anoden können entweder "Opferanoden" sein, die aus demselben Material wie die Beschichtung bestehen und sich auflösen, um Ionen im Bad aufzufüllen, oder "inerte" Anoden, die aus einem nicht reaktiven Material wie Platin oder Kohlenstoff bestehen.
Die Stromquelle
Eine Gleichstromquelle (DC), wie ein Gleichrichter, liefert die elektrische Energie, die zur Steuerung der Reaktion benötigt wird. Spannung und Strom werden sorgfältig kontrolliert, um die Rate und Qualität der Abscheidung zu steuern.
Der schrittweise elektrochemische Prozess
Mit den vorhandenen Komponenten entfaltet sich der Prozess als eine kontrollierte Abfolge elektrochemischer Ereignisse.
Anlegen des Stroms
Sobald der Gleichstrom eingeschaltet wird, wird ein elektrisches Potenzial zwischen Anode und Kathode aufgebaut. Dies erzeugt ein elektrisches Feld im gesamten Elektrolytbad.
Ionenwanderung
Angetrieben von diesem elektrischen Feld beginnen geladene Teilchen (Ionen) in der Lösung sich zu bewegen. Positiv geladene Ionen, bekannt als Kationen (z. B. Cu²⁺), werden zur negativ geladenen Kathode (dem Werkstück) gezogen.
Die Reduktionsreaktion an der Kathode
Dies ist das Herzstück des Beschichtungsprozesses. Wenn die Kationen die Oberfläche der Kathode erreichen, nehmen sie Elektronen auf. Dieser chemische Prozess wird Reduktion genannt. Die Aufnahme von Elektronen neutralisiert ihre Ladung, wodurch sie sich als fester Metallfilm auf der Oberfläche ablagern.
Für Kupfer lautet die Reaktion: Cu²⁺ (in Lösung) + 2e⁻ → Cu (feste Beschichtung)
Die Oxidationsreaktion an der Anode
Gleichzeitig findet an der Anode eine entsprechende Reaktion namens Oxidation statt, bei der eine Substanz Elektronen verliert. Wenn eine Opferanode verwendet wird, löst sie sich langsam im Bad auf, füllt die Metallionen auf, die an der Kathode abgeschieden wurden, und gewährleistet einen stabilen Prozess.
Die Reaktion der Kupfer-Opferanode ist: Cu (feste Anode) → Cu²⁺ (in Lösung) + 2e⁻
Die Kompromisse verstehen
Obwohl leistungsstark, ist die Elektroabscheidung keine Universallösung. Das Verständnis ihrer Vorteile und Einschränkungen ist entscheidend für ihre richtige Anwendung.
Vorteil: Präzision und Gleichmäßigkeit
Die Hauptstärke der Elektroabscheidung ist ihre Fähigkeit, hochgleichmäßige Beschichtungen zu erzeugen, selbst auf Objekten mit komplexen Geometrien, Löchern und Innenflächen. Diese "Streufähigkeit" ist mit Sichtlinienmethoden wie dem Spritzlackieren schwer zu erreichen.
Vorteil: Starke Haftung
Da die Beschichtung durch eine elektrochemische Bindung auf atomarer Ebene gebildet wird, ist die Haftung zwischen dem Substrat und der abgeschiedenen Schicht außergewöhnlich stark und haltbar.
Einschränkung: Nur leitfähige Substrate
Der Prozess beruht grundsätzlich darauf, dass das Werkstück Elektrizität leiten kann. Nichtleitende Materialien wie Kunststoffe oder Keramiken können nicht direkt beschichtet werden, ohne zuvor mit einer leitfähigen Schicht behandelt worden zu sein.
Einschränkung: Umwelt- und Sicherheitsbedenken
Viele industrielle Elektrolytbäder enthalten gefährliche Materialien wie starke Säuren, Schwermetalle oder Cyanide. Dies erfordert strenge Prozesskontrollen, spezialisierte Abfallbehandlung und robuste Sicherheitsprotokolle zum Schutz der Arbeiter und der Umwelt.
Die richtige Wahl für Ihr Ziel treffen
Die Entscheidung für die Elektroabscheidung hängt von Ihrem spezifischen technischen Ziel ab.
- Wenn Ihr Hauptaugenmerk auf Korrosionsbeständigkeit liegt: Die Elektroabscheidung ist eine ausgezeichnete Wahl für das Aufbringen von Schutzschichten wie Zink (Verzinken) oder Nickel, die eine dichte, porenfreie Barriere gegen die Elemente bilden.
- Wenn Ihr Hauptaugenmerk auf Ästhetik oder Leitfähigkeit liegt: Der Prozess ist ideal für dekorative Oberflächen wie Chrom, Gold und Silber oder für das Aufbringen hochleitfähiger Kupferschichten in der Elektronikfertigung.
- Wenn Ihr Hauptaugenmerk auf der Beschichtung komplexer, komplizierter Formen liegt: Die Fähigkeit der Elektroabscheidung, alle benetzten Oberflächen gleichmäßig zu bedecken, macht sie fast jeder anderen Methode für Teile mit komplexen internen oder externen Merkmalen überlegen.
Durch die Beherrschung des Zusammenspiels von Chemie und Elektrizität bietet die Elektroabscheidung eine unübertroffene Kontrolle, um eine Oberfläche für einen bestimmten Bedarf zu konstruieren.
Zusammenfassungstabelle:
| Komponente | Rolle bei der Elektroabscheidung |
|---|---|
| Elektrolytbad | Lösung, die gelöste Ionen des Beschichtungsmaterials enthält. |
| Kathode | Das zu beschichtende Objekt; zieht positive Ionen an. |
| Anode | Schließt den Stromkreis; kann Opferanode oder inert sein. |
| Stromquelle | Liefert den Gleichstrom (DC) zur Steuerung der Reaktion. |
| Wichtige Überlegung | Vorteil / Einschränkung |
|---|---|
| Beschichtungsgleichmäßigkeit | Hervorragend für komplexe Formen (Vorteil) |
| Haftung | Starke, atomare Bindung (Vorteil) |
| Substrat | Erfordert eine leitfähige Oberfläche (Einschränkung) |
| Prozess | Beinhaltet gefährliche Materialien (Einschränkung) |
Bereit für Präzisionsbeschichtungen in Ihrem Labor?
Der kontrollierte Prozess der Elektroabscheidung ist unerlässlich für Anwendungen, die gleichmäßige Metallschichten erfordern, vom Korrosionsschutz bis zur elektronischen Leitfähigkeit. KINTEK ist spezialisiert auf die Bereitstellung der zuverlässigen Laborausrüstung und Verbrauchsmaterialien, die Sie benötigen, um Ihre Elektroabscheideprozesse sicher und effizient zu perfektionieren.
Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen die Fähigkeiten Ihres Labors verbessern und Ihnen helfen können, Ihre spezifischen Beschichtungsziele zu erreichen.
Visuelle Anleitung
Ähnliche Produkte
- HFCVD-Maschinensystemausrüstung für Ziehstein-Nanodiamantbeschichtung
- 915MHz MPCVD Diamantmaschine Mikrowellen-Plasma-Chemische Gasphasenabscheidung Systemreaktor
- Labor-Prübsiebe und Siebmaschinen
- CVD-Diamant-Schneidwerkzeugrohlinge für die Präzisionsbearbeitung
- RRDE-Rotations-Scheiben (Ring-Scheiben)-Elektrode / Kompatibel mit PINE, japanischem ALS, Schweizer Metrohm Glaskohlenstoff-Platin
Andere fragen auch
- Was sind die Vorteile der HFCVD für BDD-Elektroden? Effiziente Skalierung der industriellen Diamantenproduktion
- Wie werden Reaktanten während eines CVD-Prozesses in die Reaktionskammer eingebracht? Beherrschen von Vorläufer-Zuliefersystemen
- Was ist die Heißdraht-Chemische Gasphasenabscheidung (HFCVD) von Diamant? Ein Leitfaden zur Synthetischen Diamantbeschichtung
- Wie verbessert PACVD-Ausrüstung DLC-Beschichtungen? Geringe Reibung und hohe Hitzebeständigkeit freischalten
- Was ist die spezifische Funktion des Metallfilaments bei der HF-CVD? Schlüsselrollen beim Diamantwachstum



















