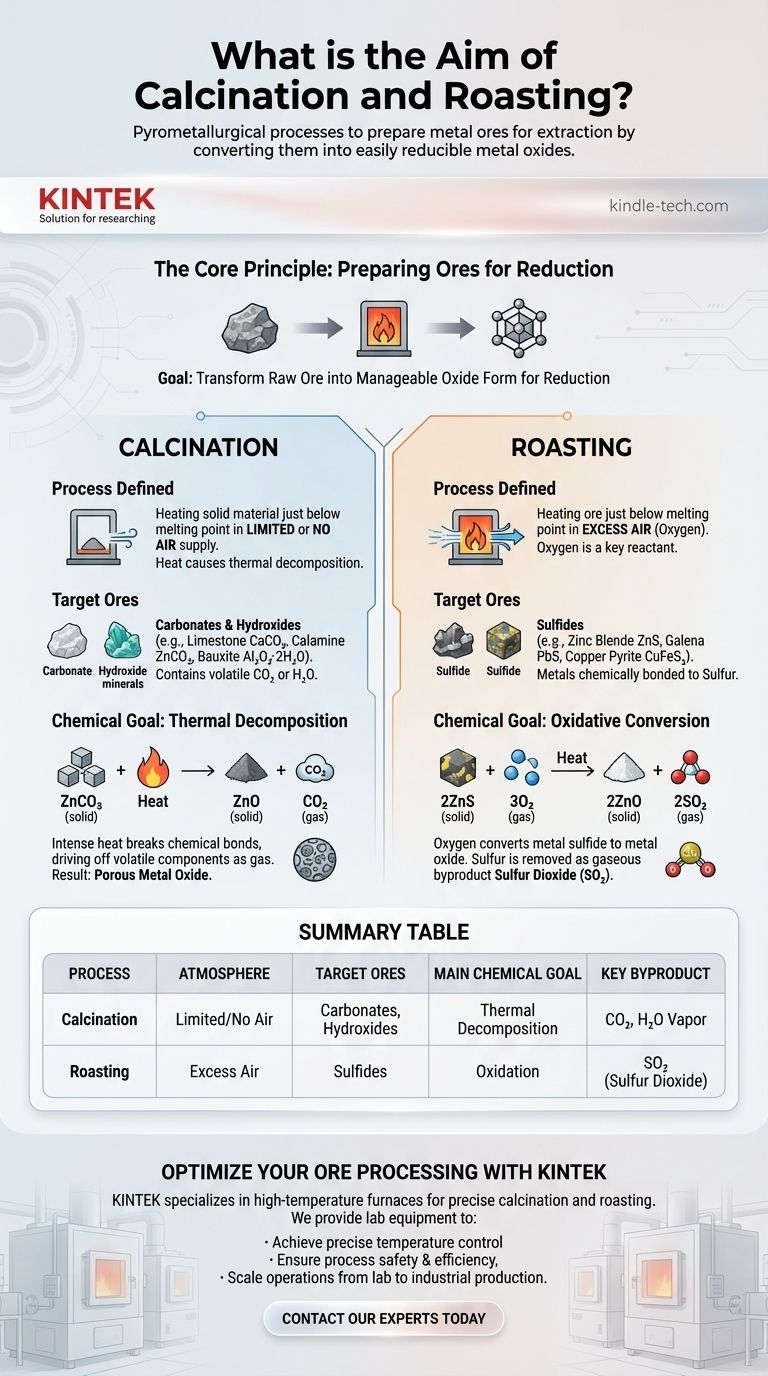
Kurz gesagt, Kalzinierung und Röstung sind pyrometallurgische Prozesse, die darauf abzielen, Metallerze für die Gewinnung vorzubereiten. Beide nutzen hohe Hitze, um Erze in Metalloxide umzuwandeln, eine chemische Form, die viel leichter zu reinem Metall reduziert werden kann. Die Kalzinierung erreicht dies durch thermische Zersetzung des Erzes bei begrenzter oder keiner Luftzufuhr, während die Röstung einen Überschuss an Luft verwendet, um das Erz zu oxidieren.
Der wesentliche Unterschied liegt in der Art des behandelten Erzes. Die Kalzinierung ist für Erze bestimmt, die sich durch Hitze allein zersetzen, wie Karbonate und Hydroxide. Die Röstung ist für Erze bestimmt, die Sauerstoff zur Umwandlung benötigen, hauptsächlich Sulfide.

Das Kernprinzip: Vorbereitung der Erze für die Reduktion
Das ultimative Ziel der Metallurgie ist die Gewinnung eines reinen Metalls aus seinem natürlich vorkommenden Erz. Die meisten Erze, wie Karbonate (z. B. Kalkstein) oder Sulfide (z. B. Zinkblende), lassen sich nicht ohne Weiteres direkt in Metall umwandeln.
Metalloxide hingegen lassen sich leicht zu ihrer metallischen Form „reduzieren“, oft durch Reaktion mit Kohlenstoff (Koks) in einem Hochtemperaturofen. Daher dienen sowohl Kalzinierung als auch Röstung als entscheidender Vorbehandlungsschritt: um das Rohmaterial in diese besser handhabbare Oxidform umzuwandeln.
Die Kalzinierung verstehen
Der definierte Prozess
Die Kalzinierung beinhaltet das Erhitzen eines Feststoffs auf eine hohe Temperatur, knapp unterhalb seines Schmelzpunkts, in vollständigem oder sehr begrenztem Luftausschluss.
Die Hitze selbst ist der primäre Wirkstoff, der den Stoff zersetzt, ohne ihn zu verbrennen.
Die Zielerze
Dieser Prozess ist ideal für Karbonat- und Hydroxiderze. Diese Erze enthalten flüchtige Bestandteile wie Kohlendioxid (CO₂) oder Wasser (H₂O), die chemisch in ihrer Struktur gebunden sind.
Häufige Beispiele sind Kalkstein (CaCO₃), Calamin (ZnCO₃) und Bauxit (Al₂O₃·2H₂O).
Das chemische Ziel: Thermische Zersetzung
Das Ziel der Kalzinierung ist die thermische Zersetzung. Die intensive Hitze bricht die chemischen Bindungen im Erz auf und treibt flüchtige Bestandteile als Gas aus.
Für ein Karbonaterz wie Zinkkarbonat ist die Reaktion einfach:
ZnCO₃ (fest) + Hitze → ZnO (fest) + CO₂ (Gas)
Das Ergebnis ist ein festes, poröses Metalloxid (Zinkoxid), das für die nächste Reduktionsstufe bereit ist.
Die Röstung verstehen
Der definierte Prozess
Die Röstung beinhaltet das Erhitzen eines Erzes auf eine hohe Temperatur, ebenfalls unterhalb seines Schmelzpunkts, jedoch in Gegenwart eines Überschusses an Luft (Sauerstoff).
Im Gegensatz zur Kalzinierung ist Sauerstoff ein wichtiger Reaktionspartner in diesem Prozess.
Die Zielerze
Die Röstung ist die Standardmethode zur Verarbeitung von sulfidischen Erzen. Diese Erze enthalten wertvolle Metalle, die chemisch an Schwefel gebunden sind.
Bekannte Beispiele sind Zinkblende (ZnS), Galenit (PbS) und Kupferkies (CuFeS₂).
Das chemische Ziel: Oxidative Umwandlung
Das Ziel der Röstung ist es, Sauerstoff aus der Luft zu verwenden, um das Metallsulfid in ein Metalloxid umzuwandeln. Schwefel wird als gasförmiges Nebenprodukt, Schwefeldioxid (SO₂), entfernt.
Für ein Sulfiderz wie Zinkblende lautet die Reaktion:
2ZnS (fest) + 3O₂ (Gas) + Hitze → 2ZnO (fest) + 2SO₂ (Gas)
Diese Reaktion ersetzt den Schwefel durch Sauerstoff und erzeugt wiederum das gewünschte Metalloxid (Zinkoxid).
Die Abwägungen und Hauptunterschiede verstehen
Luftzufuhr: Der entscheidende Faktor
Der kritischste Unterschied ist die Atmosphäre im Ofen.
Die Kalzinierung erfordert den Ausschluss von Luft, um sicherzustellen, dass sich das Erz einfach zersetzt. Die Röstung erfordert reichlich Luft, um den für die Oxidationsreaktion benötigten Sauerstoff bereitzustellen.
Nebenproduktmanagement
Die Nebenprodukte jedes Prozesses unterscheiden sich grundlegend und haben unterschiedliche ökologische und wirtschaftliche Auswirkungen.
Die Kalzinierung erzeugt hauptsächlich Kohlendioxid (CO₂) oder Wasserdampf, die relativ harmlos sind. Die Röstung erzeugt Schwefeldioxid (SO₂), einen großen Luftschadstoff, der für sauren Regen verantwortlich ist. Moderne Schmelzöfen müssen dieses SO₂ auffangen, das oft zur Herstellung von Schwefelsäure verwendet wird, wodurch ein schädliches Abfallprodukt in eine wertvolle Ware umgewandelt wird.
Warum nicht einfach ein Sulfiderz kalzinieren?
Das Erhitzen eines Sulfiderzes ohne Luft (Kalzinierung) würde den Schwefel nicht effektiv entfernen oder ihn in ein Oxid umwandeln. Der Prozess ist auf Sauerstoff angewiesen, um die Metall-Schwefel-Bindung aufzubrechen und die stabilere Metall-Sauerstoff-Bindung zu bilden.
Auswahl des korrekten Vorbehandlungsprozesses
Die Wahl zwischen Kalzinierung und Röstung ist keine Frage der Präferenz, sondern eine chemische Notwendigkeit, die durch die Zusammensetzung des Erzes bestimmt wird.
- Wenn Ihr Hauptaugenmerk auf der Verarbeitung eines Karbonat- oder Hydroxiderzes liegt: Verwenden Sie die Kalzinierung, um das Erz thermisch zu zersetzen und Kohlendioxid oder Wasser auszutreiben.
- Wenn Ihr Hauptaugenmerk auf der Verarbeitung eines Sulfiderzes liegt: Verwenden Sie die Röstung, um das Erz mit überschüssiger Luft zu oxidieren, es in ein Metalloxid umzuwandeln und Schwefel als Schwefeldioxid zu entfernen.
Die Zuordnung des korrekten pyrometallurgischen Prozesses zur spezifischen Erzchemie ist der grundlegende Schritt für eine effiziente und erfolgreiche Metallgewinnung.
Zusammenfassungstabelle:
| Prozess | Atmosphäre | Zielerze | Hauptsächliches chemisches Ziel | Wichtigstes Nebenprodukt |
|---|---|---|---|---|
| Kalzinierung | Begrenzte/Keine Luft | Karbonate, Hydroxide | Thermische Zersetzung | CO₂, H₂O Dampf |
| Röstung | Überschüssige Luft | Sulfide | Oxidation | SO₂ (Schwefeldioxid) |
Optimieren Sie Ihre Erzverarbeitung mit KINTEK
Das Verständnis des richtigen Vorbehandlungsprozesses ist der erste Schritt zu einer effizienten Metallgewinnung. KINTEK ist spezialisiert auf die Lieferung der robusten Hochtemperaturofen, die für präzise Kalzinierungs- und Röstvorgänge erforderlich sind.
Wir liefern die wesentliche Laborausrüstung und Verbrauchsmaterialien, um Sie zu unterstützen:
- Präzise Temperaturkontrolle für effektive thermische Zersetzung oder Oxidation erreichen.
- Prozesssicherheit und Effizienz gewährleisten, unabhängig davon, ob Sie mit Karbonaten oder Sulfiden arbeiten.
- Ihre Abläufe von der Laborforschung bis zur industriellen Produktion skalieren.
Bereit, Ihre pyrometallurgischen Prozesse zu verbessern? Kontaktieren Sie unsere Experten noch heute, um die perfekte Ofenlösung für Ihre spezifische Erzchemie und Ihre Produktionsziele zu besprechen.
Visuelle Anleitung
Ähnliche Produkte
- Rotationsrohrofen mit geteilter Mehrfachheizzone
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
- Labor-Vakuum-Kipp-Drehrohröfen Drehrohröfen
- Labor-Muffelofen-Bodenhub-Muffelofen
Andere fragen auch
- Was ist ein Pyrolyse-Reaktor? Ein Leitfaden zur Umwandlung von Abfall in wertvolle Ressourcen
- Was sind die drei Produkte der Biomassepyrolyse? Ein Leitfaden zu Biokohle, Bioöl und Synthesegas
- Was passiert in der Kalzinierungszone eines Drehrohrofens? Ein Leitfaden zur effizienten thermischen Zersetzung
- Wie lange dauert die Kunststoffpyrolyse? Von Minuten bis zu Tagen, es hängt von Ihrem System ab
- Was sind die Betriebsbedingungen für die Pyrolyse? Temperatur, Aufheizrate und Verweilzeit meistern
- Welche Gase entstehen bei der Pyrolyse? Beherrschung der Produktion von Synthesegas, Bio-Öl und Bio-Kohle
- Was ist der Prozess der Abfallpyrolyse? Eine Schritt-für-Schritt-Anleitung zur Umwandlung von Abfall in wertvolle Ressourcen
- Was ist der Prozess des Pyrolyse-Abfallmanagements? Verwandeln Sie Abfall in wertvolle Ressourcen



















