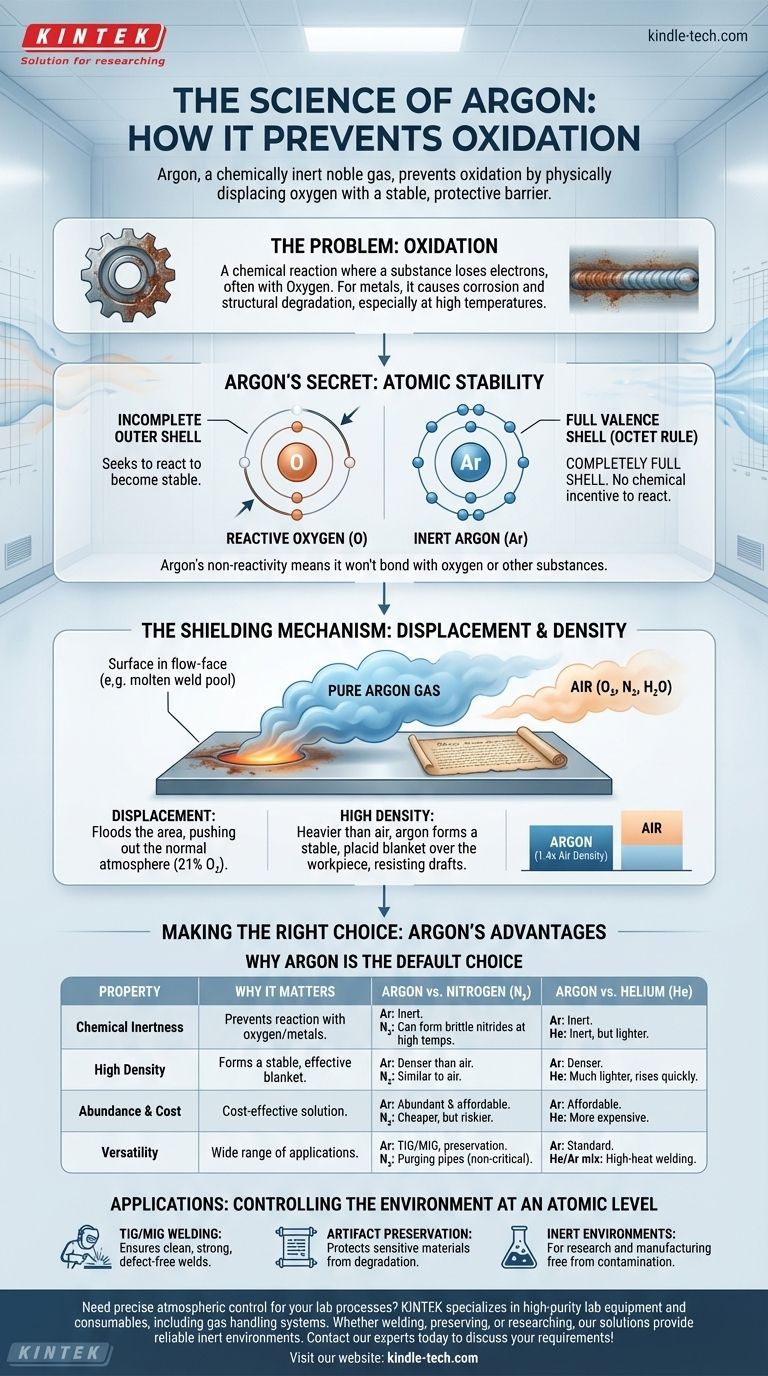
Im Grunde genommen verhindert Argon Oxidation, weil es sich um ein chemisch inertes Edelgas handelt, das Sauerstoff physikalisch von einer Oberfläche verdrängt. Seine Atomstruktur macht es unwillig, mit anderen Elementen zu reagieren, während seine Dichte es ihm ermöglicht, eine stabile, schützende Barriere zu bilden, die Sauerstoff und andere atmosphärische Verunreinigungen blockiert.
Der Schlüssel zum Verständnis der Wirkung von Argon liegt in seiner atomaren Stabilität. Mit einer perfekt gefüllten äußeren Elektronenschale hat Argon keinen chemischen Anreiz zur Reaktion, was es zu einem idealen, nicht reaktiven Schutzschild gegen die hochreaktive Natur von Sauerstoff macht.

Die Chemie der Oxidation
Was Oxidation ist
Oxidation ist eine chemische Reaktion, bei der eine Substanz Elektronen verliert. Obwohl der Name von Sauerstoff stammt, der ein sehr häufiger Vermittler dieses Prozesses ist, kann sie auch mit anderen Elementen auftreten.
Bei Metallen wird dieser Prozess allgemein als Korrosion oder Rost bezeichnet. Die Reaktion zersetzt das Material, schwächt seine Struktur und beeinträchtigt seine Integrität.
Warum es ein Problem ist
Bei Prozessen wie dem Schweißen wird das Metall in einen geschmolzenen Zustand erhitzt, wodurch es extrem anfällig für Oxidation wird. Der Kontakt mit Sauerstoff bei diesen Temperaturen kann Oxide bilden, was zu spröden Schweißnähten, schlechter Durchdringung und katastrophalem Strukturversagen führen kann.
Ebenso können empfindliche Gegenstände wie historische Dokumente oder erlesener Wein durch langsame, langfristige Oxidation durch die Luft geschädigt werden.
Argons Geheimnis: Eine volle Valenzschale
Die Definition eines Edelgases
Argon gehört zur Gruppe 18 des Periodensystems, bekannt als die Edelgase. Diese Gruppe, zu der auch Helium, Neon und Xenon gehören, zeichnet sich durch ihre extreme chemische Trägheit aus.
Die Kraft der Oktettregel
Der Grund für diese Inertheit liegt in ihrer Elektronenkonfiguration. Atome streben nach Stabilität, die sie typischerweise erreichen, indem sie eine volle äußere (oder Valenz-) Elektronenschale besitzen, meistens acht. Dies ist als die Oktettregel bekannt.
Stellen Sie sich die Valenzschale eines Atoms wie eine Tanzkarte vor. Atome wie Sauerstoff haben eine unvollständige Karte und suchen aggressiv nach Partnern (Elektronen), um stabil zu werden. Argon hingegen kommt mit einer vollständig gefüllten Tanzkarte an.
Warum dies Argon nicht reaktiv macht
Da die äußere Elektronenschale von Argon bereits voll ist, hat es keine Neigung, Elektronen mit anderen Atomen abzugeben, aufzunehmen oder zu teilen. Es ist chemisch zufrieden und stabil.
Diese grundlegende Nichtreaktivität bedeutet, dass es selbst unter extremen Hitze- oder Druckbedingungen keine Bindungen mit Sauerstoff, heißem Metall oder anderen Substanzen eingeht. Es existiert einfach als neutrale Präsenz.
Der Abschirmmechanismus: Verdrängung und Schutz
Schaffung einer sauerstofffreien Zone
Die primäre Methode, mit der Argon eine Oberfläche schützt, ist die Verdrängung. Indem man einen Bereich mit reinem Argon flutet, drängt man die normale Atmosphäre, die aus etwa 21 % Sauerstoff und 78 % Stickstoff sowie Wasserdampf besteht, physisch heraus.
Dadurch entsteht eine lokalisierte, sauerstofffreie Umgebung um den empfindlichen Bereich, wie z. B. eine Schweißnaht oder eine antike Handschrift in einer Vitrine.
Die Rolle der Dichte
Argon ist etwa 1,4-mal dichter als Luft. Dies ist eine entscheidende physikalische Eigenschaft für Abschirmanwendungen.
Da es schwerer ist, neigt Argon dazu, sich abzusetzen und eine stabile, ruhige Decke über dem Werkstück zu bilden. Dies bietet einen konsistenten Schutz, der durch Zugluft weniger leicht gestört wird als bei leichteren Gasen wie Helium.
Die Abwägungen verstehen
Warum nicht einfach Stickstoff verwenden?
Stickstoffgas (N₂) wird oft als Spülgas verwendet und ist wesentlich billiger als Argon. Es ist jedoch nicht wirklich inert.
Bei den hohen Temperaturen des Schweißens kann Stickstoff mit bestimmten Metallen wie Titan und einigen Edelstählen reagieren, um Nitride zu bilden. Diese Verbindungen können das Metall spröde machen, weshalb Argon für einen chemisch reinen Prozess erforderlich ist.
Argon im Vergleich zu Helium
Helium ist das einzige andere Edelgas, das häufig für Schutzatmosphären verwendet wird, aber es hat andere Eigenschaften. Es ist viel leichter als Luft und hat eine höhere Wärmeleitfähigkeit.
Die höhere Wärmeübertragung eines Helium-Argon-Gemisches kann beim Schweißen sehr dicker Abschnitte leitfähiger Metalle wie Aluminium nützlich sein. Helium ist jedoch teurer und seine geringe Dichte führt dazu, dass es schnell aufsteigt, was höhere Durchflussraten erfordert, um die Abdeckung aufrechtzuerhalten.
Die Kosteneffizienz von Argon
Argon macht fast 1 % der Erdatmosphäre aus und ist damit das am häufigsten vorkommende und billigste aller Edelgase. Diese Kombination aus perfekter Inertheit, idealer Dichte und Erschwinglichkeit macht es zur Standardwahl für die überwiegende Mehrheit der Abschirmanwendungen.
Die richtige Wahl für Ihre Anwendung treffen
Die Wahl eines Schutzgases erfordert die Abstimmung seiner Eigenschaften auf Ihr spezifisches Ziel.
- Wenn Ihr Hauptaugenmerk auf dem WIG- oder MIG-Schweißen der meisten Stähle und Aluminiums liegt: Argon ist aufgrund seiner ausgezeichneten Lichtbogenstabilität, idealen Dichte und Kosteneffizienz der Industriestandard.
- Wenn Ihr Hauptaugenmerk auf der Konservierung empfindlicher Artefakte oder Lebensmittel liegt: Argon ist überlegen, da seine vollständige Inertheit und Dichte eine permanente, nicht reaktive Schutzdecke bilden.
- Wenn Ihr Hauptaugenmerk auf dem Hochgeschwindigkeitsschweißen oder dem Tiefenschweißen dicker Nichteisenmetalle liegt: Möglicherweise ist eine spezielle Argon/Helium-Mischung erforderlich, um die höhere thermische Energie von Helium zu nutzen.
- Wenn Ihr Hauptaugenmerk lediglich auf dem Spülen von Rohren oder Behältern für nicht kritische Anwendungen liegt: Stickstoff kann eine kostengünstigere Wahl sein, sofern er nicht mit den beteiligten Materialien reagiert.
Letztendlich ermöglicht Ihnen das Verständnis der chemischen Stabilität von Argon, die Umgebung auf atomarer Ebene zu kontrollieren.
Zusammenfassungstabelle:
| Eigenschaft | Warum sie für die Oxidationsprävention wichtig ist |
|---|---|
| Chemische Inertheit | Argon reagiert selbst bei hohen Temperaturen nicht mit Sauerstoff oder heißen Metallen. |
| Hohe Dichte | Schwerer als Luft, bildet es eine stabile Decke, die Sauerstoff effektiv verdrängt. |
| Häufigkeit & Kosten | Macht 1 % der Atmosphäre aus und bietet eine kostengünstige Abschirmungslösung. |
| Vielseitigkeit | Ideal für WIG/MIG-Schweißen, Artefaktschutz und die Schaffung inerter Umgebungen. |
Benötigen Sie eine präzise atmosphärische Kontrolle für Ihre Laborprozesse? KINTEK ist spezialisiert auf hochreine Laborgeräte und Verbrauchsmaterialien, einschließlich Gasversorgungssysteme, um sicherzustellen, dass Ihre Experimente und Produktionen frei von Kontaminationen sind. Egal, ob Sie schweißen, empfindliche Materialien konservieren oder forschen – unsere Lösungen bieten die zuverlässigen inerten Umgebungen, die Sie benötigen. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir Ihre spezifischen Laboranforderungen unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1700℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Kann Stickstoff zum Löten verwendet werden? Wichtige Bedingungen und Anwendungen erklärt
- Warum wird Stickstoff im Ofen verwendet? Ein kostengünstiger Schutz für Hochtemperaturprozesse
- Welche Gase werden in inerten Atmosphären verwendet? Wählen Sie das richtige Gas für nicht-reaktive Umgebungen
- Was versteht man unter einer Inertatmosphäre? Ein Leitfaden zur Verhinderung von Oxidation und Gewährleistung der Sicherheit
- Was ist eine Wärmebehandlung unter inerter Atmosphäre? Schützen Sie Ihre Metalle vor Oxidation & Entkohlung



















