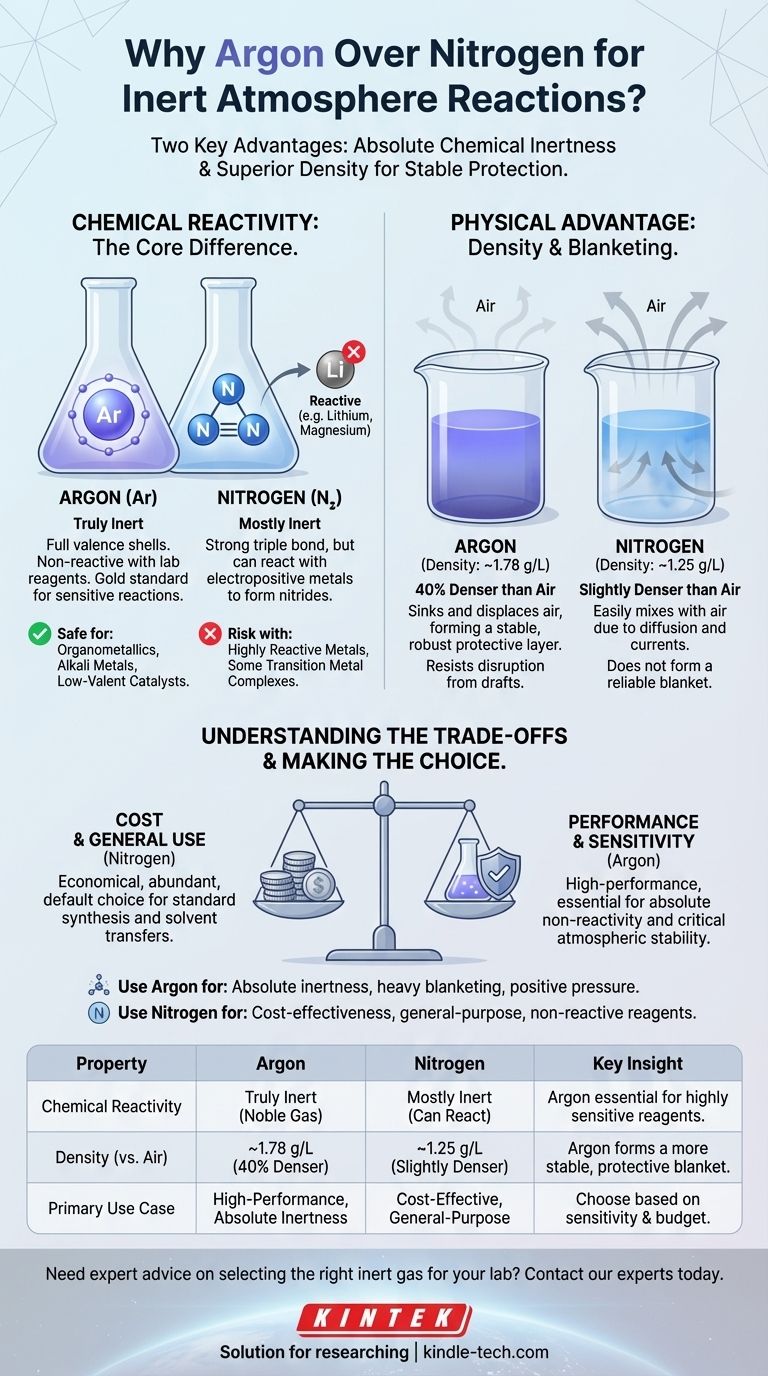
In der Praxis wird Argon aufgrund zweier Schlüsselmerkmale oft als "besser" als Stickstoff für Reaktionen unter inerter Atmosphäre angesehen. Argon ist ein wirklich inertes Edelgas, das nicht in der Lage ist, mit Laborreagenzien zu reagieren, während Stickstoff unter bestimmten Bedingungen reagieren kann. Darüber hinaus ermöglicht die höhere Dichte von Argon, eine stabilere und schützendere "Decke" über einer Reaktion zu bilden, die die Luft effektiver verdrängt.
Die Wahl zwischen Argon und Stickstoff hängt nicht davon ab, welches universell besser ist, sondern welches für eine bestimmte Aufgabe besser geeignet ist. Stickstoff ist das wirtschaftliche Arbeitspferd für allgemeine Inertisierung, während Argon die Hochleistungsoption für Reaktionen ist, die absolute Nichtreaktivität und atmosphärische Stabilität erfordern.

Der Kernunterschied: Chemische Reaktivität
Der grundlegendste Grund, ein Gas dem anderen vorzuziehen, liegt in seinem Potenzial, an Ihrer Reaktion teilzunehmen.
Argon: Die Definition von Inert
Argon ist ein Edelgas. Seine Valenzelektronenschalen sind vollständig gefüllt, was es unter praktisch allen Laborbedingungen außergewöhnlich stabil und nicht reaktiv macht.
Für einen Chemiker ist dies der Goldstandard. Sie können sicher sein, dass Argon Ihre Reaktion nicht stört, egal wie empfindlich die Reagenzien sind.
Stickstoff: "Meistens" Inert
Stickstoffgas (N₂) besteht aus zwei Stickstoffatomen, die durch eine sehr starke Dreifachbindung verbunden sind. Diese Bindung erfordert viel Energie, um sie zu brechen, weshalb N₂ meistens inert ist und für viele Anwendungen gut geeignet ist.
Es ist jedoch nicht völlig unreaktiv. Hochreaktive Reagenzien, insbesondere elektropositive Metalle wie Lithium, Magnesium und einige Übergangsmetallkomplexe, können mit N₂ reagieren und Metallnitride bilden. Diese unerwünschte Nebenreaktion kann Ihre Ausbeute reduzieren oder Verunreinigungen einführen.
Der physikalische Vorteil: Dichte
Neben der chemischen Reaktivität ist das physikalische Verhalten des Gases im Labor ein entscheidender Faktor. Luft ist ein Gasgemisch, hat aber eine durchschnittliche Dichte, die wir vergleichen können.
- Argon-Dichte: ~1,78 g/L
- Luftdichte: ~1,23 g/L
- Stickstoff-Dichte: ~1,25 g/L
Wie Dichte eine schützende "Decke" erzeugt
Argon ist ungefähr 40 % dichter als Luft. Wenn Sie einen Kolben mit Argon spülen, sinkt es effektiv ab und verdrängt die leichtere Luft, drückt sie nach oben und hinaus. Es legt sich dann über Ihr Reaktionsgemisch und bildet eine stabile, schwere Decke, die Störungen widersteht.
Stickstoff hingegen ist nur geringfügig dichter als Luft. Es ist weitaus anfälliger für die Vermischung mit Luft aufgrund von Diffusion und geringfügigen Zugluft oder Konvektionsströmen im Raum. Es bildet nicht die gleiche robuste Schutzschicht.
Praktische Auswirkungen für Laboraufbauten
Dieser Dichteunterschied hat reale Konsequenzen. In einer Handschuhbox oder an einer Schlenklinie sorgt ein Überdruck von Argon für eine nachsichtigere Atmosphäre. Tritt ein kleines Leck auf, strömt das dichte Argon bevorzugt aus, wodurch verhindert wird, dass leichtere Luft eindringt.
Für Techniken, die das Abdecken eines offenen Gefäßes erfordern, wie bei vielen elektrochemischen Experimenten, ist Argon weitaus überlegen, da es über der Lösung verbleibt. Stickstoff würde sich fast sofort mit der Umgebungsluft vermischen.
Die Kompromisse verstehen
Die Wahl des idealen Gases erfordert ein Abwägen zwischen Leistung und praktischen Einschränkungen.
Kosten: Der entscheidende Faktor für viele
Stickstoff macht etwa 78 % der Erdatmosphäre aus, während Argon weniger als 1 % ausmacht. Dieser Unterschied in der Häufigkeit macht Stickstoff erheblich billiger in der Herstellung und im Einkauf.
Für großtechnische industrielle Prozesse oder routinemäßige Laborverfahren, bei denen keine extreme Inertheit erforderlich ist, sind die Kosteneinsparungen durch die Verwendung von Stickstoff erheblich und machen ihn oft zur Standardwahl.
Reaktivität: Wenn "meistens" inert gut genug ist
Die potenzielle Reaktivität von Stickstoff spielt nur dann eine Rolle, wenn Ihr chemisches System in der Lage ist, diese N≡N-Dreifachbindung zu brechen.
Für die überwiegende Mehrheit der organischen Reaktionen, Reinigungen und Lösungsmitteltransfers ist Stickstoff völlig ausreichend. Die Reagenzien sind einfach nicht reaktiv genug, um Nitride zu bilden, wodurch Argon eine unnötige Ausgabe wäre.
Die richtige Wahl für Ihre Reaktion treffen
Treffen Sie Ihre Entscheidung auf der Grundlage der spezifischen Anforderungen Ihres chemischen Verfahrens und der praktischen Gegebenheiten Ihres Labors.
- Wenn Ihr Hauptaugenmerk auf absoluter Inertheit für empfindliche Reagenzien liegt: Verwenden Sie Argon bei der Arbeit mit Organometallverbindungen (insbesondere solchen mit Li, Mg), Alkalimetallen, niedrigvalenten Übergangsmetallkatalysatoren oder jedem System, bei dem die Nitridbildung ein bekanntes Risiko darstellt.
- Wenn Ihr Hauptaugenmerk auf Kosteneffizienz und allgemeiner Verwendung liegt: Verwenden Sie Stickstoff für die meisten Standard-Organosynthesen, Lösungsmittelkolonnen, Rekristallisationen und andere Verfahren, die keine außergewöhnlich reaktiven Spezies beinhalten.
- Wenn Ihr Hauptaugenmerk auf der Aufrechterhaltung einer stabilen Atmosphäre liegt: Verwenden Sie Argon für Techniken, die eine schwere Gasdecke erfordern, wie z. B. die Elektrochemie, oder in Aufbauten, bei denen die Aufrechterhaltung eines Überdrucks gegen potenzielle Lecks entscheidend ist.
Letztendlich befähigt Sie das Verständnis der unterschiedlichen chemischen und physikalischen Eigenschaften jedes Gases, die fundierteste und wirtschaftlichste Wahl für Ihr Experiment zu treffen.
Zusammenfassungstabelle:
| Eigenschaft | Argon | Stickstoff | Wichtige Erkenntnis |
|---|---|---|---|
| Chemische Reaktivität | Wirklich inert (Edelgas) | Meistens inert, kann aber mit elektropositiven Metallen reagieren | Argon ist für hochreaktive Reagenzien unerlässlich. |
| Dichte (vs. Luft) | ~1,78 g/L (40 % dichter) | ~1,25 g/L (geringfügig dichter) | Argon bildet eine stabilere, schützendere Decke. |
| Primärer Anwendungsfall | Hochleistungsreaktionen, die absolute Inertheit erfordern | Kostengünstige Lösung für allgemeine Inertisierung | Wählen Sie basierend auf der Empfindlichkeit Ihrer Reaktion und Ihrem Budget. |
Benötigen Sie fachkundige Beratung bei der Auswahl des richtigen Inertgases für Ihre spezifische Laboranwendung?
KINTEK ist spezialisiert auf die Bereitstellung von hochreinen Laborgasen und -geräten, einschließlich Argon- und Stickstoffsystemen, um sicherzustellen, dass Ihre empfindlichen Reaktionen perfekt geschützt sind. Unser Team kann Ihnen helfen, Ihr Setup für maximale Ausbeute und Sicherheit zu optimieren.
Kontaktieren Sie noch heute unsere Experten, um Ihre Anforderungen an eine inerte Atmosphäre zu besprechen und die effizienteste Lösung für Ihr Labor zu finden.
Visuelle Anleitung
Ähnliche Produkte
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Was ist die Rolle von Stickstoff im Glühprozess? Schaffung einer kontrollierten, schützenden Atmosphäre
- Was ist eine Stickstoffatmosphäre beim Glühen? Erzielung einer oxidfreien Wärmebehandlung
- Kann Stickstoffgas erhitzt werden? Nutzen Sie die inerte Hitze für Präzision und Sicherheit
- Wie erzeugt man eine inerte Atmosphäre? Beherrschen Sie sichere, reine Prozesse durch Inertisierung
- Warum wird Stickstoff in Glühöfen verwendet? Um Oxidation und Entkohlung für eine überlegene Metallqualität zu verhindern



















