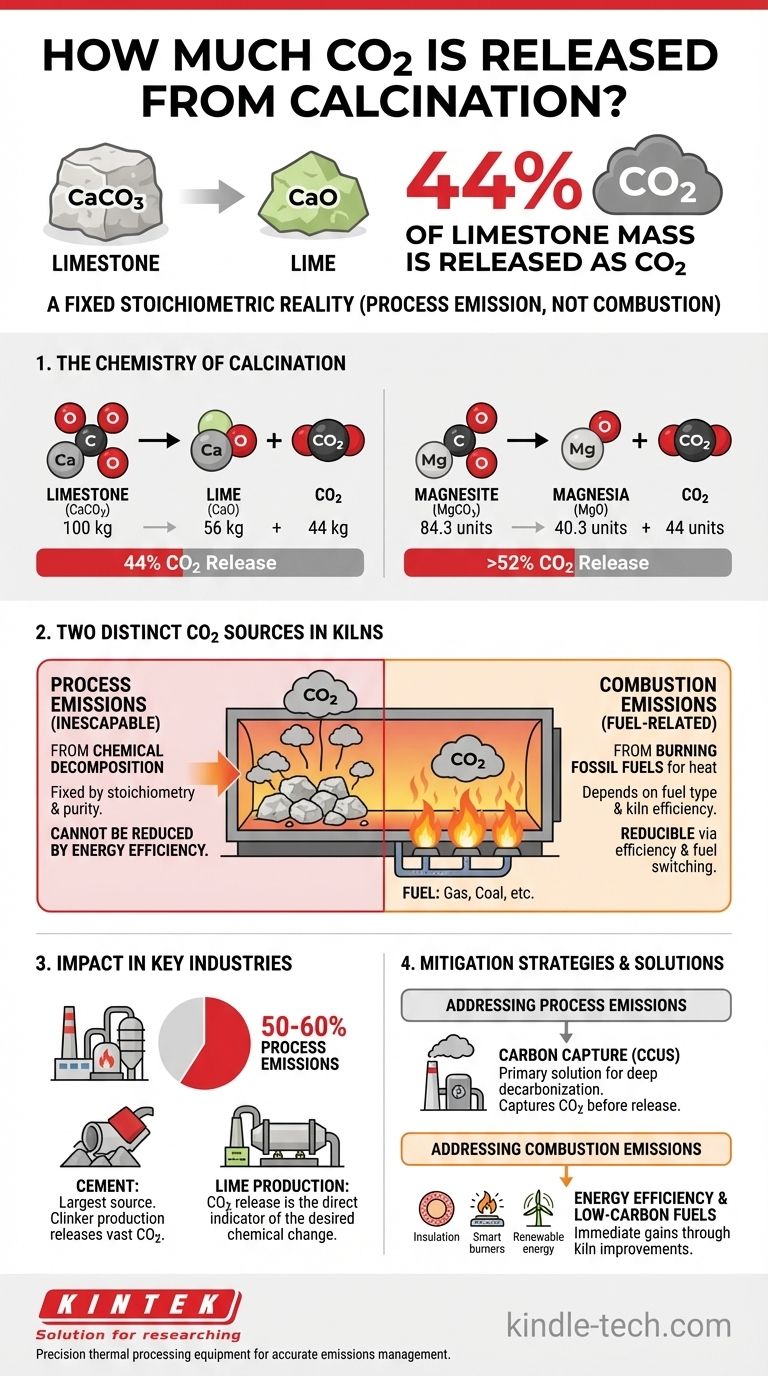
Bei der Kalzinierung von Kalkstein (Kalziumkarbonat) werden 44 % seiner Masse als Kohlendioxid freigesetzt. Für jede 1.000 kg reines Kalziumkarbonat, das verarbeitet wird, werden unvermeidbar 440 kg CO2 als direktes Ergebnis der chemischen Umwandlung freigesetzt.
Das Kernprinzip, das es zu verstehen gilt, ist, dass das bei der Kalzinierung freigesetzte CO2 eine Prozess-Emission und keine Verbrennungs-Emission ist. Es wird direkt aus der chemischen Struktur des Rohmaterials freigesetzt und ist somit ein unvermeidbarer Bestandteil der Reaktion, unabhängig vom zur Erhitzung verwendeten Brennstoff.

Die Chemie der Kalzinierung: Eine stöchiometrische Realität
Die Kalzinierung ist ein thermischer Zersetzungsprozess. Wenn bestimmte Materialien, insbesondere Karbonate, auf eine hohe Temperatur erhitzt werden, zerfallen sie in ein neues festes Produkt (normalerweise ein Oxid) und setzen ein Gas frei.
Kalziumkarbonat (Kalkstein)
Das häufigste industrielle Beispiel ist die Kalzinierung von Kalkstein (CaCO3) zur Herstellung von Branntkalk (CaO).
Die ausgeglichene chemische Gleichung lautet: CaCO3 → CaO + CO2
Betrachtet man die Atommassen (Ca≈40, C≈12, O≈16), so sieht man, dass 100 Einheiten CaCO3 in 56 Einheiten CaO und 44 Einheiten CO2 zerfallen. Dieses Massenverhältnis von 44 % ist eine feste chemische Tatsache.
Magnesiumkarbonat (Magnesit)
Eine ähnliche Reaktion findet bei Magnesiumkarbonat (MgCO3) statt, das zu Magnesia (MgO) kalziniert wird.
Die Gleichung lautet: MgCO3 → MgO + CO2
Hier zerfallen etwa 84,3 Einheiten MgCO3 in 40,3 Einheiten MgO und 44 Einheiten CO2. Das bedeutet, dass bei Magnesit über 52 % der ursprünglichen Masse als CO2 freigesetzt werden.
Die Quelle des Kohlendioxids
Es ist entscheidend zu erkennen, dass dieses CO2 chemisch im Gestein selbst eingeschlossen war. Die hohe Hitze liefert lediglich die Energie, die benötigt wird, um die chemischen Bindungen aufzubrechen und das Gas freizusetzen, das bereits in der Molekülstruktur des Materials vorhanden war.
Prozess-Emissionen vs. Verbrennungs-Emissionen
In jedem realen Ofen gibt es zwei unterschiedliche CO2-Quellen, und die Nichtbeachtung dieser Unterscheidung führt zu erheblichen Verwirrungen im Emissionsmanagement.
Prozess-Emissionen (Das unvermeidbare CO2)
Dies ist das CO2, das aus der chemischen Zersetzung des Karbonat-Ausgangsmaterials freigesetzt wird, wie oben beschrieben. Es wird vollständig durch die Stöchiometrie der Reaktion und die Reinheit des Rohmaterials bestimmt.
Verbrennungs-Emissionen (Das brennstoffbedingte CO2)
Dies ist das CO2, das durch die Verbrennung fossiler Brennstoffe (wie Erdgas, Kohle oder Petrolkoks) entsteht, um die für die Kalzinierung erforderlichen hohen Temperaturen (oft >900 °C) zu erreichen. Dieser Teil der Emissionen hängt von der Brennstoffart und der thermischen Effizienz des Ofens ab.
Warum diese Unterscheidung entscheidend ist
Sie können die Verbrennungs-Emissionen reduzieren, indem Sie die Ofenisolierung verbessern, effizientere Brenner einsetzen oder auf kohlenstoffarme Brennstoffe umsteigen. Sie können jedoch die Prozess-Emissionen nicht durch Energieeffizienz reduzieren. Das CO2 aus dem Gestein wird freigesetzt, unabhängig davon, ob Sie es mit Erdgas, Strom oder konzentrierter Solarenergie heizen.
Auswirkungen der Kalzinierung in Schlüsselindustrien
Die stöchiometrische Freisetzung von CO2 macht die Kalzinierung zu einem wichtigen Schwerpunkt für industrielle Dekarbonisierungsbemühungen.
Die Zementindustrie
Die Zementherstellung ist die größte Einzelquelle für Kalzinierungs-Emissionen weltweit. Die Herstellung von Klinker, dem Schlüsselbestandteil von Zement, beinhaltet die Kalzinierung enormer Mengen an Kalkstein.
Prozess-Emissionen aus der Kalzinierung machen 50–60 % des gesamten CO2-Fußabdrucks moderner Zementwerke aus. Der Rest stammt aus der Brennstoffverbrennung.
Kalkherstellung
Der gesamte Zweck eines Kalkofens besteht darin, CaO aus CaCO3 herzustellen. Daher ist die Freisetzung von CO2 nicht nur ein Nebenprodukt, sondern ein direkter Indikator dafür, dass die gewünschte chemische Umwandlung stattgefunden hat.
Häufige Fallstricke und Minderungsstrategien
Das Verständnis der Art von Kalzinierungs-Emissionen ist der Schlüssel zur Entwicklung wirksamer Strategien zu deren Bewältigung.
Die Ineffizienzfalle
Ein häufiger Fehler ist die Annahme, dass eine Steigerung der Energieeffizienz eines Ofens seine CO2-Emissionen eliminiert. Obwohl dies ein entscheidender Schritt zur Reduzierung der Verbrennungs-Emissionen ist, bewirkt es absolut nichts, um die Prozess-Emissionen zu stoppen.
Die Rolle der Kohlenstoffabscheidung
Da Prozess-Emissionen chemisch unvermeidbar sind, besteht die primäre technologische Lösung für eine tiefgreifende Dekarbonisierung in Sektoren wie Zement und Kalk in der Abscheidung, Nutzung und Speicherung von Kohlenstoff (CCUS). Diese Technologie fängt CO2 aus den Rauchgasen ab, bevor es in die Atmosphäre gelangt.
Alternative Materialien
Langfristige Forschung konzentriert sich auf die Entwicklung alternativer Baumaterialien, die nicht auf der Karbonatkalzinierung beruhen, wodurch das Problem von vornherein aus dem Prozess herausdesignt wird.
So quantifizieren Sie CO2 für Ihren Prozess
Ihr Ansatz zur Messung und Steuerung von CO2 hängt von Ihrem spezifischen Ziel ab. Nutzen Sie die Prinzipien der Stöchiometrie als Grundlage.
- Wenn Ihr Hauptaugenmerk auf der genauen Emissionsberichterstattung liegt: Sie müssen Prozess-Emissionen basierend auf der Masse und chemischen Zusammensetzung Ihres Karbonat-Ausgangsmaterials berechnen und dann separat die Verbrennungs-Emissionen basierend auf dem Kraftstoffverbrauch berechnen.
- Wenn Ihr Hauptaugenmerk auf der Emissionsreduzierung liegt: Zielen Sie zuerst auf Verbrennungs-Emissionen durch Energieeffizienz und Kraftstoffwechsel für sofortige Gewinne ab, während Sie die Kohlenstoffabscheidung als langfristige Lösung für die unvermeidbaren Prozess-Emissionen bewerten.
- Wenn Ihr Hauptaugenmerk auf der Prozessgestaltung und der Massenbilanz liegt: Berücksichtigen Sie den erheblichen Massenverlust (44 % bei reinem Kalkstein) Ihres festen Ausgangsmaterials, wenn es sich in Gas umwandelt, da dies die Materialflüsse und die Berechnung der Produktausbeute grundlegend beeinflusst.
Das Verständnis der festen, stöchiometrischen Natur von Kalzinierungs-Emissionen ist der erste und wichtigste Schritt zur Bewältigung des CO2-Fußabdrucks dieser wesentlichen industriellen Prozesse.
Zusammenfassungstabelle:
| Material | Chemische Reaktion | Ca. freigesetztes CO2 (nach Masse) |
|---|---|---|
| Kalkstein (CaCO3) | CaCO3 → CaO + CO2 | 44% |
| Magnesit (MgCO3) | MgCO3 → MgO + CO2 | >52% |
Benötigen Sie präzise thermische Verarbeitungsanlagen, um Ihren Kalzinierungsprozess und dessen Emissionen zu steuern? KINTEK ist spezialisiert auf Hochleistungs-Laboröfen und -Schmelzöfen, die für präzise Temperaturkontrolle und Prozesseffizienz entwickelt wurden. Ob Sie in der F&E, der Zement- oder der Kalkproduktion tätig sind, unsere Ausrüstung hilft Ihnen, optimale Ergebnisse zu erzielen und liefert gleichzeitig die Daten, die für eine genaue Emissionsrechnung erforderlich sind. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen Ihre spezifischen Kalzinierungs- und Dekarbonisierungsziele unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- Labor-Vakuum-Kipp-Drehrohröfen Drehrohröfen
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Labor-Schnelltemperatur-Prozess (RTP) Quarzrohr-Ofen
- Labor-Muffelofen-Bodenhub-Muffelofen
Andere fragen auch
- Was ist ein Drehrohrofen? Der ultimative Leitfaden für gleichmäßige Erwärmung & Mischung
- Was sind die Prozessvorteile der Verwendung eines Rotationsrohr-Ofens für WS2-Pulver? Überlegene Materialkristallinität erzielen
- Welche Reaktionsbedingungen bieten Hochtemperatur-Rohröfen für die Biokohle-Reduktion? Optimierung der Erzaufbereitung
- Was sind die Vorteile der Verwendung eines Drehrohrrohrofens für MoVOx-Katalysatoren? Erhöhung der Gleichmäßigkeit und Kristallinität
- Warum wird ein Hochtemperatur-Muffelofen mit Mehrfachmessspitzen für ABO3-Perowskite verwendet? Erhalten Sie präzise Leitfähigkeitsdaten



















