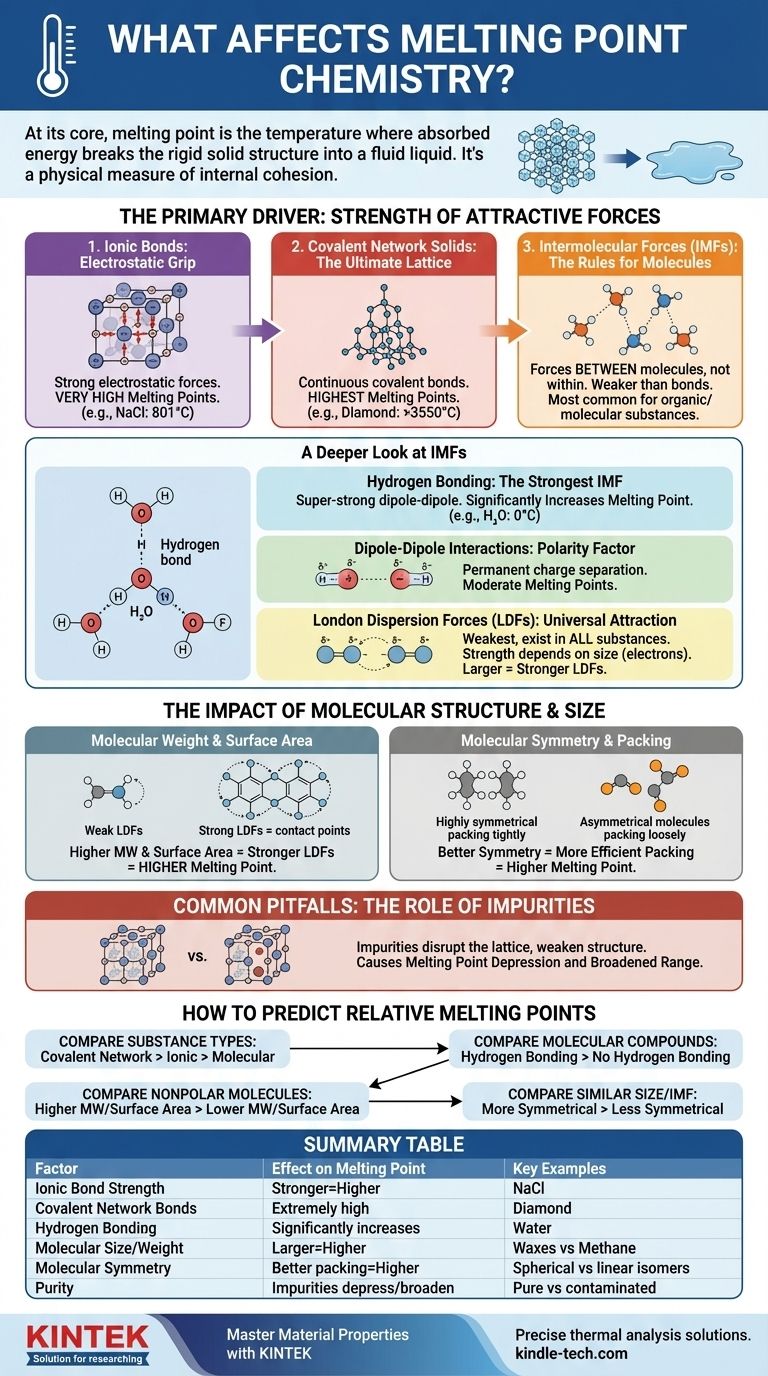
Im Kern ist der Schmelzpunkt einer Substanz die Temperatur, bei der sie genug Energie aufgenommen hat, um die starre, geordnete Struktur eines Festkörpers zu durchbrechen und in eine ungeordnete, flüssige Phase überzugehen. Dies wird durch zwei Hauptfaktoren bestimmt: die Stärke der anziehenden Kräfte, die die Partikel (Atome, Ionen oder Moleküle) zusammenhalten, und die Effizienz, mit der diese Partikel in einem festen Kristallgitter packen.
Der Schmelzpunkt ist nicht nur eine Zahl; er ist ein physikalisches Maß für den inneren Zusammenhalt einer Substanz. Um ihn zu verstehen, müssen Sie zunächst die dominante Kraft identifizieren, die die Partikel zusammenhält – sei es eine starke Ionenbindung oder eine schwache intermolekulare Anziehung – und dann berücksichtigen, wie Molekülgröße und -form diesen Wert verfeinern.

Der Haupttreiber: Stärke der anziehenden Kräfte
Die Energiemenge, die zum Aufbrechen eines festen Gitters benötigt wird, ist direkt proportional zur Stärke der Kräfte, die es zusammenhalten. Diese Kräfte existieren in einem weiten Spektrum, von unglaublich starken chemischen Bindungen bis hin zu viel schwächeren intermolekularen Kräften.
Ionenbindungen: Der elektrostatische Griff
Ionenverbindungen, wie Kochsalz (NaCl), werden durch starke elektrostatische Anziehungen zwischen positiven und negativen Ionen zusammengehalten. Diese Kräfte erzeugen ein sehr stabiles Kristallgitter.
Das Überwinden dieser starken Anziehungen erfordert eine enorme Menge an thermischer Energie, weshalb Ionenverbindungen typischerweise sehr hohe Schmelzpunkte haben.
Kovalente Netzwerkfeststoffe: Das ultimative Gitter
In einem kovalenten Netzwerkfeststoff, wie Diamant oder Quarz (SiO₂), sind Atome nicht nur aneinander angezogen; sie sind durch ein kontinuierliches Netzwerk starker kovalenter Bindungen verbunden. Es gibt keine einzelnen Moleküle, die getrennt werden könnten.
Um eine solche Substanz zu schmelzen, müssen Sie beginnen, diese starken kovalenten Bindungen zu brechen. Dies erfordert mehr Energie als jede andere Art von Wechselwirkung, was diesen Materialien die höchsten Schmelzpunkte aller Substanzen verleiht.
Intermolekulare Kräfte (IMK): Die Regeln für Moleküle
Bei molekularen Verbindungen (wie Wasser, Zucker oder Wachs) geht es beim Schmelzpunkt nicht darum, die kovalenten Bindungen innerhalb der Moleküle zu brechen. Es geht darum, die schwächeren Anziehungskräfte zwischen den Molekülen zu überwinden. Diese werden als intermolekulare Kräfte (IMK) bezeichnet.
Ein tieferer Blick auf intermolekulare Kräfte (IMK)
Die Art und Stärke der IMK sind der wichtigste Faktor für die Bestimmung des Schmelzpunkts der meisten organischen und molekularen Substanzen. Sie sind im Allgemeinen viel schwächer als vollständige chemische Bindungen.
Wasserstoffbrückenbindungen: Die stärkste IMK
Dies ist eine spezielle, superstarke Art der Dipol-Dipol-Wechselwirkung, die auftritt, wenn Wasserstoff an ein stark elektronegatives Atom wie Stickstoff (N), Sauerstoff (O) oder Fluor (F) gebunden ist.
Die resultierende Anziehung zwischen Molekülen ist signifikant. Wasser (H₂O) ist ein klassisches Beispiel; seine Wasserstoffbrückenbindungen verleihen ihm einen viel höheren Schmelzpunkt (0 °C), als es für ein Molekül seiner Größe zu erwarten wäre.
Dipol-Dipol-Wechselwirkungen: Der Polaritätsfaktor
Polare Moleküle haben eine permanente Ladungstrennung, die ein positives und ein negatives Ende erzeugt, wie winzige Magnete. Diese molekularen "Pole" ziehen sich gegenseitig an.
Diese Kräfte sind stärker als die Kräfte zwischen unpolaren Molekülen ähnlicher Größe, was zu moderaten Schmelzpunkten führt.
London-Dispersionskräfte (LDF): Die universelle Anziehung
LDFs sind die schwächste Art von IMK und existieren in allen Substanzen. Sie entstehen durch die zufälligen, vorübergehenden Schwankungen in der Elektronenverteilung um ein Molekül, die flüchtige, momentane Dipole erzeugen.
Die Stärke der LDFs hängt direkt von der Größe des Moleküls (insbesondere seiner Elektronenzahl) ab. Größere Moleküle haben größere, "schwabbeligere" Elektronenwolken, was sie polarisierbarer macht und zu stärkeren LDFs führt. Aus diesem Grund können große, unpolare Moleküle wie Wachs bei Raumtemperatur noch fest sein.
Der Einfluss von Molekülstruktur und -größe
Neben der Art der Kraft spielen die spezifische Form und Größe eines Moleküls eine entscheidende Rolle bei der Verfeinerung seines Schmelzpunkts.
Molekulargewicht und Oberfläche
Bei Molekülen mit der gleichen dominanten IMK (z. B. beim Vergleich zweier unpolarer Moleküle) hat das Molekül mit dem höheren Molekulargewicht stärkere LDFs und daher einen höheren Schmelzpunkt. Eine größere Oberfläche ermöglicht mehr Kontaktpunkte zwischen den Molekülen, was auch die LDFs verstärkt.
Molekulare Symmetrie und Packung
Symmetrie hat eine tiefgreifende Wirkung. Hochsymmetrische Moleküle können sich effizienter und dichter zu einem stabilen Kristallgitter zusammenfügen, wie gut gemachte LEGO-Steine.
Diese dichte, geordnete Anordnung erfordert mehr Energie, um sie aufzubrechen. Daher hat ein symmetrischeres Molekül oft einen signifikant höheren Schmelzpunkt als ein weniger symmetrisches Isomer, selbst wenn sie die gleiche Formel und das gleiche Gewicht haben.
Häufige Fehler vermeiden: Die Rolle von Verunreinigungen
In einem praktischen, realen Kontext ist einer der häufigsten Faktoren, die den Schmelzpunkt beeinflussen, die Reinheit der Probe.
Störung des Kristallgitters
Verunreinigungen sind Fremdpartikel, die nicht sauber in das Kristallgitter der Substanz passen. Sie führen Defekte ein und schwächen die Gesamtstruktur.
Da das Gitter bereits gestört ist, wird weniger Energie benötigt, um es aufzubrechen, was zu einem niedrigeren Schmelzpunkt führt. Dieses Phänomen ist als Schmelzpunktdepression bekannt.
Ein verbreiterter Schmelzbereich
Eine reine Substanz schmilzt typischerweise über einen sehr engen Temperaturbereich (oft weniger als 1 °C). Das Vorhandensein von Verunreinigungen senkt nicht nur den Schmelzpunkt, sondern führt auch dazu, dass die Substanz über einen breiteren, ausgedehnteren Temperaturbereich schmilzt. Chemiker nutzen diese Eigenschaft, um die Reinheit einer synthetisierten Verbindung zu beurteilen.
So sagen Sie relative Schmelzpunkte voraus
Beim Vergleich zweier Substanzen arbeiten Sie diese Hierarchie von Fragen durch, um eine genaue Vorhersage zu treffen.
- Wenn Ihr Hauptaugenmerk auf dem Vergleich verschiedener Substanztypen liegt: Ein kovalenter Netzwerkfeststoff (Diamant) hat einen höheren Schmelzpunkt als eine Ionenverbindung (Salz), die wiederum viel höher ist als eine molekulare Verbindung (Zucker).
- Wenn Ihr Hauptaugenmerk auf dem Vergleich zweier molekularer Verbindungen liegt: Prüfen Sie zuerst auf Wasserstoffbrückenbindungen. Das Molekül, das Wasserstoffbrückenbindungen bilden kann, hat fast immer einen höheren Schmelzpunkt als eines, das dies nicht kann, vorausgesetzt, die Größe ist ähnlich.
- Wenn Ihr Hauptaugenmerk auf dem Vergleich zweier unpolarer Moleküle liegt: Das Molekül mit dem höheren Molekulargewicht und der größeren Oberfläche hat stärkere London-Dispersionskräfte und einen höheren Schmelzpunkt.
- Wenn Ihr Hauptaugenmerk auf dem Vergleich zweier Moleküle ähnlicher Größe und IMK-Typ liegt: Das symmetrischere Molekül, das effizienter in ein Kristallgitter packen kann, hat wahrscheinlich den höheren Schmelzpunkt.
Das Verständnis dieser Faktoren verwandelt den Schmelzpunkt von einem einfachen Datenpunkt in einen aussagekräftigen Indikator für die grundlegenden Molekularkräfte und die Struktur einer Substanz.
Zusammenfassungstabelle:
| Faktor | Auswirkung auf den Schmelzpunkt | Schlüsselbeispiele |
|---|---|---|
| Stärke der Ionenbindung | Stärkere Bindungen = Höherer Schmelzpunkt | Natriumchlorid (NaCl): 801°C |
| Kovalente Netzwerkbindungen | Extrem hohe Schmelzpunkte | Diamant: >3550°C |
| Wasserstoffbrückenbindungen | Erhöht den Schmelzpunkt erheblich | Wasser (H₂O): 0°C |
| Molekülgröße/-gewicht | Größere Moleküle = Höherer Schmelzpunkt (stärkere LDFs) | Wachse (hohes MW) vs. Methan (niedriges MW) |
| Molekulare Symmetrie | Bessere Packung = Höherer Schmelzpunkt | Sphärische vs. lineare Isomere |
| Reinheit | Verunreinigungen senken und verbreitern den Schmelzbereich | Reine vs. kontaminierte Proben |
Meistern Sie Materialeigenschaften mit KINTEK
Das Verständnis von Schmelzpunkten ist entscheidend für die Materialauswahl, Synthese und Qualitätskontrolle im Labor. Egal, ob Sie neue Verbindungen entwickeln oder die Materialreinheit analysieren, die richtige Ausrüstung ist unerlässlich.
KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, die für präzise und zuverlässige thermische Analysen entwickelt wurden. Unsere Produkte helfen Forschern und Laborfachleuten, Schmelzpunkte genau zu bestimmen und das Materialverhalten zu verstehen.
Bereit, die Fähigkeiten Ihres Labors zu verbessern? Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für Ihre thermischen Analyseanforderungen zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Vakuum-Wärmebehandlungs- und Levitation-Induktionsschmelzofen
- Labormaßstabs Induktionsschmelzofen mit Vakuum
- Vakuum-Induktionsschmelzspinnanlage Lichtbogen-Schmelzofen
- Beheizte Hydraulische Pressmaschine mit integrierten manuellen Heizplatten für den Laboreinsatz
- Nicht verzehrender Vakuumlichtbogen-Induktionsofen
Andere fragen auch
- Was sind die Vorteile von Drehschieberpumpen? Erschließen Sie kostengünstige, hochleistungsfähige Vakuumtechnologie
- Was ist der Unterschied zwischen Magnetronsputtern mit Gleichstrom (DC) und Wechselstrom (RF)? Wählen Sie die richtige Methode für Ihr Material
- Was sind die 6 Mechanismen des Sinterns? Wählen Sie die richtige Methode für Ihre Materialien
- Was sind die Vorteile der Nutzung von Biomasse? Erreichen Sie Lösungen für erneuerbare Energien und die Umwandlung von Abfall in Energie (Waste-to-Power).
- Warum ist ein mehrstufiger Reinigungsprozess mit Aceton und Ethanol notwendig? Gewährleistung der Integrität der reinen Elektrodenoberfläche
- Ist Pyrolyseöl dasselbe wie Diesel? Die entscheidenden Unterschiede in den Kraftstoffeigenschaften aufdecken
- Was erzeugt der Prozess der langsamen Erhitzung und Niedertemperaturpyrolyse? Maximierung von Biokohle zur Kohlenstoffabscheidung
- Was sind die Wirkungen von CBD-Destillat? Ein Leitfaden zu den Wirkungen von Vollspektrum, Breitspektrum und Isolat





















