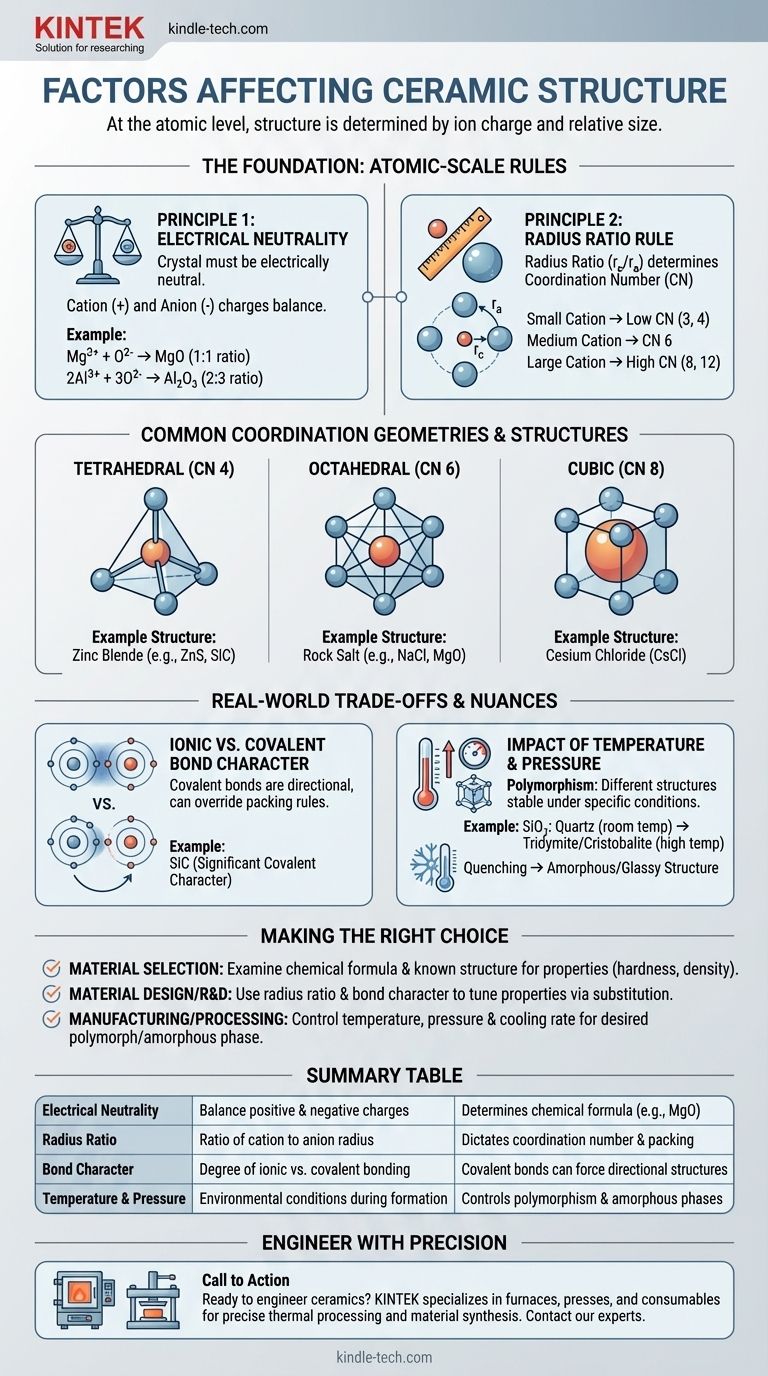
Auf atomarer Ebene wird die Kristallstruktur einer Keramik durch zwei primäre Faktoren bestimmt: die elektrische Ladung ihrer Bestandteile und die relative Größe dieser Ionen. Um eine stabile, energiearme Struktur zu bilden, muss die Anordnung der Atome die Ladungsneutralität erfüllen und gleichzeitig so geometrisch effizient wie möglich gepackt sein.
Die grundlegende Herausforderung bei der Bildung jeder keramischen Kristallstruktur besteht darin, konkurrierende Kräfte auszugleichen. Kationen und Anionen ziehen sich an und bilden dichte Strukturen, aber ihre relativen Größen bestimmen die spezifische geometrische Anordnung – die Koordinationszahl –, die physisch erreicht werden kann, während die elektrische Gesamtneutralität erhalten bleibt.
Die Grundlage: Regeln auf atomarer Ebene
Um zu verstehen, warum eine Keramik wie Magnesiumoxid (MgO) eine bestimmte Struktur bildet, während Siliziumkarbid (SiC) eine andere bildet, müssen wir mit den beiden nicht verhandelbaren Regeln beginnen, die bestimmen, wie sich Atome zu einem stabilen Kristallgitter anordnen.
Prinzip 1: Die Regel der elektrischen Neutralität
Die grundlegendste Anforderung ist, dass der Kristall elektrisch neutral sein muss. Die Summe aller positiven Ladungen der Kationen muss genau durch die Summe aller negativen Ladungen der Anionen ausgeglichen werden.
Dieses Prinzip diktiert die chemische Formel selbst. Da beispielsweise ein Magnesiumion eine +2-Ladung (Mg²⁺) und ein Sauerstoffion eine -2-Ladung (O²⁻) hat, verbinden sie sich im Verhältnis 1:1 zu MgO. Ein Aluminiumion (Al³⁺) und ein Sauerstoffion (O²⁻) müssen sich im Verhältnis 2:3 zu Al₂O₃ verbinden, um Neutralität zu erreichen.
Prinzip 2: Die Radienverhältnis-Regel
Sobald die chemische Formel festgelegt ist, übernimmt die Geometrie. Das Radienverhältnis – der Radius des Kations (r_c) geteilt durch den Radius des Anions (r_a) – ist der entscheidende Faktor, der die Koordinationszahl (KZ) bestimmt.
Die Koordinationszahl ist einfach die Anzahl der Anionen, die sich um ein zentrales Kation packen können. Stellen Sie sich vor, Sie versuchen, Basketbälle (Anionen) um einen kleineren Tennisball (Kation) zu packen. Sie können nur wenige unterbringen, bevor sie sich gegenseitig berühren. Wenn Sie den Tennisball durch einen größeren Fußball ersetzen, können Sie mehr Basketbälle darum herum unterbringen. Die relative Größe bestimmt die Packungsgeometrie.
Von der atomaren Packung zur Kristallstruktur
Diese beiden Prinzipien wirken zusammen, um die sich wiederholenden, dreidimensionalen Muster zu erzeugen, die keramische Kristallstrukturen definieren. Das Radienverhältnis sagt die Koordinationszahl voraus, und die Notwendigkeit der Ladungsneutralität diktiert dann, wie diese koordinierten Einheiten im Raum miteinander verbunden sind.
Gängige Koordinationsgeometrien
Spezifische Radienverhältnisbereiche deuten stark auf eine bevorzugte Koordinationszahl und ihre entsprechende Form hin:
- Ein kleines Kation führt zu einer niedrigen KZ, wie 3 (dreieckig) oder 4 (tetraedrisch).
- Ein mittelgroßes Kation ermöglicht eine KZ von 6 (oktaedrisch).
- Ein großes Kation, das fast die Größe des Anions hat, kann eine KZ von 8 (kubisch) oder sogar 12 erreichen.
Beispiele für gängige Keramikstrukturen
Diese Regeln führen zu bekannten Kristallstrukturen, die nach gängigen Mineralien benannt sind. Für einfache AX-Keramiken (ein Kation, ein Anion):
- Steinsalzstruktur (z.B. NaCl, MgO): Verfügt über eine Koordinationszahl von 6 sowohl für das Kation als auch für das Anion. Es ist eine sehr stabile, häufige Struktur, wenn Kation und Anion einen moderaten Größenunterschied aufweisen.
- Cäsiumchloridstruktur (CsCl): Tritt auf, wenn das Kation fast so groß wie das Anion ist, was eine dichter gepackte Koordinationszahl von 8 ermöglicht.
- Zinkblende-Struktur (z.B. ZnS, SiC): Bildet sich, wenn das Kation deutlich kleiner als das Anion ist, was zu einer Koordinationszahl von 4 (tetraedrisch) führt. Diese Struktur ist auch charakteristisch für Materialien mit starker kovalenter Bindung.
Für komplexere Formeln wie AₘXₚ (z.B. Al₂O₃, CaF₂) gelten dieselben Prinzipien. Die Struktur wird einfach zu einer komplexeren Anordnung, um sicherzustellen, dass jedes Ion seine bevorzugte Koordination erreicht und die Gesamtladung neutral bleibt.
Verständnis der Kompromisse und Einschränkungen
Obwohl diese Prinzipien einen leistungsstarken Rahmen bieten, handelt es sich um ein vereinfachtes Modell. Reale Faktoren führen zu wichtigen Nuancen, die die endgültige Struktur verändern können.
Der ionische vs. kovalente Bindungscharakter
Die Radienverhältnis-Regel funktioniert am besten für rein ionische Bindungen. Viele Keramiken, wie Siliziumkarbid (SiC) und Siliziumnitrid (Si₃N₄), weisen jedoch einen signifikanten kovalenten Charakter auf.
Kovalente Bindungen sind stark gerichtet. Atome bevorzugen es, in bestimmten Winkeln zu binden (z.B. 109,5° in einem Tetraeder). Bei diesen Materialien kann die Notwendigkeit, gerichtete kovalente Bindungen zu erfüllen, die geometrischen Packungsregeln des Radienverhältnisses außer Kraft setzen und eine spezifische Struktur wie die tetraedrische Koordination erzwingen.
Der Einfluss von Temperatur und Druck
Eine einzelne chemische Verbindung kann oft in mehreren verschiedenen Kristallstrukturen existieren, ein Phänomen, das als Polymorphie bekannt ist. Jede dieser Strukturen oder Polymorphe ist unter einem bestimmten Temperatur- und Druckbereich stabil.
Zum Beispiel existiert Siliziumdioxid (SiO₂) bei Raumtemperatur als Quarz, wandelt sich aber bei höheren Temperaturen in andere Polymorphe wie Tridymit und Cristobalit um. Diese Umwandlungen beinhalten eine Neuordnung der Atome in eine neue, stabilere Struktur für diese Bedingungen.
Wird eine geschmolzene Keramik zudem sehr schnell abgekühlt (Abschrecken), haben die Atome möglicherweise nicht genügend Zeit, sich zu einem geordneten Kristallgitter anzuordnen. Dies führt zu einer ungeordneten, amorphen oder glasartigen Struktur.
Die richtige Wahl für Ihre Anwendung treffen
Das Verständnis dieser Faktoren ermöglicht es Ihnen, die Verarbeitung und Zusammensetzung einer Keramik mit ihrer endgültigen Struktur und letztendlich ihrer Leistung zu verbinden.
- Wenn Ihr Hauptaugenmerk auf der Materialauswahl liegt: Beginnen Sie mit der Untersuchung der chemischen Formel und der bekannten Kristallstruktur. Eine dichte, hochkoordinierte Struktur wie Korund (Al₂O₃) impliziert hohe Härte und Dichte, während eine niedriger koordinierte Struktur andere Eigenschaften haben kann.
- Wenn Ihr Hauptaugenmerk auf Materialdesign oder F&E liegt: Nutzen Sie das Radienverhältnis und den Bindungscharakter als Ihre Werkzeuge. Das Ersetzen von Atomen mit unterschiedlichen Größen oder Elektronegativitäten kann verwendet werden, um die Kristallstruktur gezielt zu verschieben und ihre Eigenschaften abzustimmen.
- Wenn Ihr Hauptaugenmerk auf Fertigung und Verarbeitung liegt: Ihre Schlüsselvariablen sind Temperatur, Druck und Abkühlgeschwindigkeit. Verwenden Sie diese, um zu steuern, welches Polymorph sich bildet oder um zwischen einem kristallinen und einem amorphen Endprodukt zu entscheiden.
Indem Sie das Zusammenspiel von Ladung, Größe und Verarbeitungsbedingungen verstehen, können Sie von der bloßen Verwendung von Keramiken dazu übergehen, diese gezielt für einen bestimmten Zweck zu entwickeln.
Zusammenfassungstabelle:
| Faktor | Beschreibung | Wichtige Auswirkung auf die Struktur |
|---|---|---|
| Elektrische Neutralität | Die gesamten positiven und negativen Ladungen im Kristall müssen sich ausgleichen. | Bestimmt die chemische Formel (z.B. MgO, Al₂O₃). |
| Radienverhältnis | Das Verhältnis des Kationenradius zum Anionenradius (r_c/r_a). | Diktieren die Koordinationszahl und Packungsgeometrie (z.B. tetraedrisch, oktaedrisch). |
| Bindungscharakter | Der Grad der ionischen vs. kovalenten Bindung. | Kovalente Bindungen können gerichtete Strukturen erzwingen und einfache Packungsregeln außer Kraft setzen. |
| Temperatur & Druck | Die Umgebungsbedingungen während der Bildung und Verarbeitung. | Kontrolliert Polymorphie (verschiedene Kristallformen) und die Bildung amorpher/glasartiger Phasen. |
Bereit, Keramiken präzise zu entwickeln? Die richtige Laborausrüstung ist entscheidend für die Kontrolle der Faktoren, die die Struktur und Leistung Ihres Materials bestimmen. KINTEK ist spezialisiert auf die Öfen, Pressen und Verbrauchsmaterialien, die Ihr Labor für präzise thermische Verarbeitung und Materialsynthese benötigt. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen Ihnen helfen können, Ihre spezifischen Materialziele zu erreichen.
Visuelle Anleitung
Ähnliche Produkte
- Siliziumkarbid (SiC) Keramikplatte Verschleißfeste technische fortschrittliche Fein Keramik
- Präzisionsbearbeitete Siliziumnitrid (SiN) Keramikplatte für die Entwicklung fortschrittlicher Feinkeramik
- Labor-Prübsiebe und Siebmaschinen
- Präzisionsgefertigte Zirkoniumdioxid-Keramikkugel für fortschrittliche Fein keramische Werkstoffe
- Technische Keramik Aluminiumoxid Al2O3 Kühlkörper für Isolierung
Andere fragen auch
- Was ist das Besondere an Keramik? Unübertroffene Haltbarkeit gegenüber Hitze, Verschleiß und Chemikalien
- Welchen Einfluss hat die Heizrate auf den Sintermechanismus von Aluminiumoxid-Nanopartikeln? Kontrolle von Dichte und Festigkeit
- Was ist die Brenntemperatur von Aluminiumoxid? Den Bereich von 1300°C bis 1700°C für optimale Ergebnisse meistern
- Was sind die Eigenschaften von Siliziumkarbidrohren? Meistern Sie extreme Bedingungen mit unübertroffener Haltbarkeit
- Gibt es eine Alternative zur Porzellan-Krone? Entdecken Sie Ihre besten Optionen für Stärke & Ästhetik
- Ist Siliziumkarbid hitzebeständig? Erschließen Sie überragende Leistung bei extremen Temperaturen
- Welche physikalischen Veränderungen treten während des Sinterns von Keramikpulvern auf? Meistern Sie die Umwandlung zu dichten, starken Bauteilen
- Wofür wird Porzellanpulver verwendet? Von Zahnkronen bis zu feinem Porzellan



















