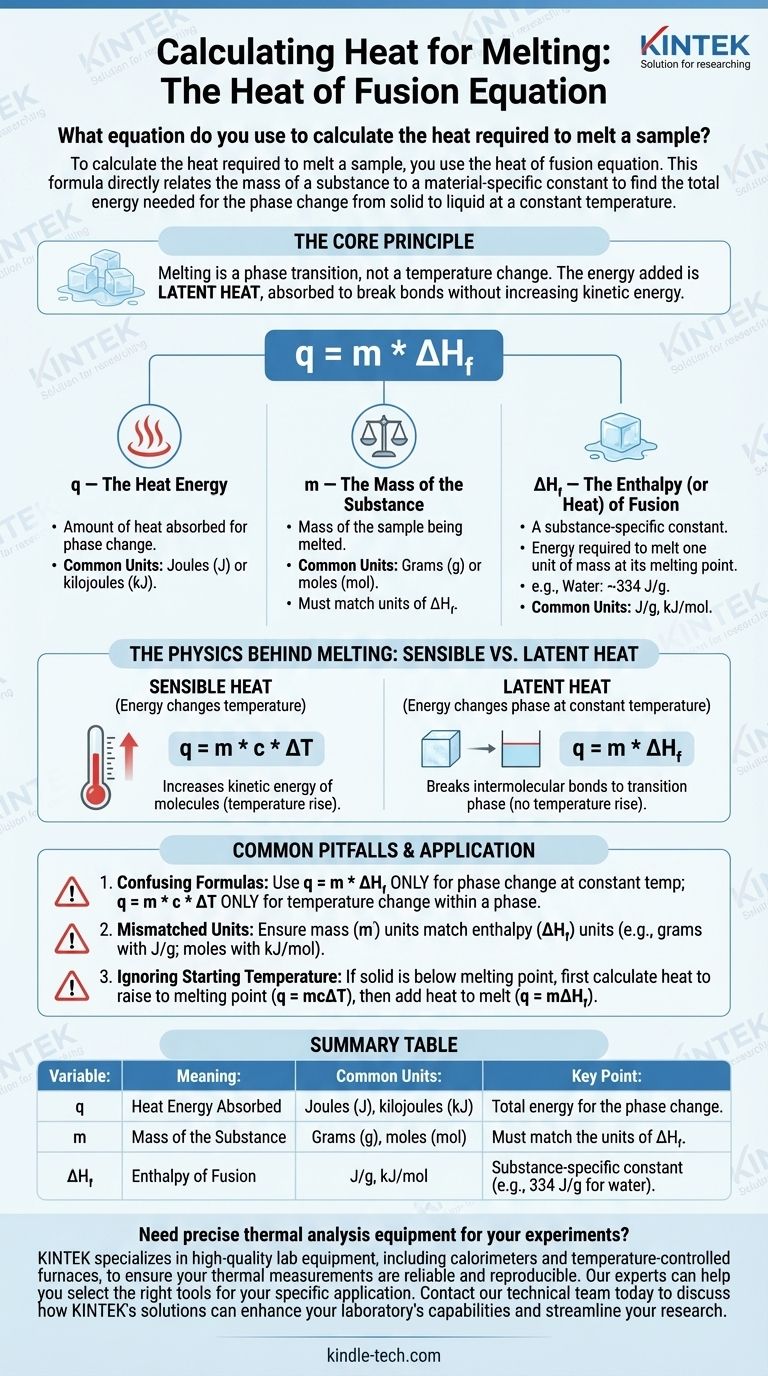
Um die zum Schmelzen einer Probe erforderliche Wärme zu berechnen, verwenden Sie die Schmelzwärmegleichung. Diese Formel setzt die Masse einer Substanz direkt mit einer materialspezifischen Konstante in Beziehung, um die Gesamtenergie zu ermitteln, die für den Phasenübergang von fest zu flüssig bei konstanter Temperatur benötigt wird.
Das Kernprinzip ist, dass Schmelzen ein Phasenübergang und keine Temperaturänderung ist. Die hinzugefügte Energie wird als latente Wärme bezeichnet, die absorbiert wird, um die Bindungen der festen Struktur aufzubrechen, ohne die kinetische Energie der Moleküle zu erhöhen.

Die Schmelzwärmegleichung entschlüsseln
Die Formel zur Berechnung der während des Schmelzens absorbierten Wärme lautet:
q = m * ΔH_f
Jede Variable in dieser Gleichung repräsentiert einen kritischen Teil des physikalischen Prozesses. Das individuelle Verständnis ist der Schlüssel zur korrekten Anwendung der Formel.
q — Die Wärmeenergie
q repräsentiert die Wärmemenge, die von der Substanz absorbiert wird, um den Phasenübergang zu durchlaufen. Dieser Wert wird typischerweise in Joule (J) oder Kilojoule (kJ) ausgedrückt, obwohl in älteren Kontexten auch Kalorien (cal) verwendet werden können.
m — Die Masse der Substanz
m ist die Masse der Probe, die Sie schmelzen. Es ist entscheidend, dass die Masseeinheiten, typischerweise Gramm (g) oder Mol (mol), mit den Einheiten der Schmelzwärmekonstante für diese Substanz übereinstimmen.
ΔH_f — Die Enthalpie (oder Wärme) der Fusion
ΔH_f ist die wichtigste Variable. Es ist die Schmelzenthalpie, oft auch als latente Schmelzwärme bezeichnet.
Dies ist eine physikalische Konstante, die für jede Substanz einzigartig ist. Sie definiert die Energiemenge, die erforderlich ist, um eine Masseneinheit (z. B. 1 Gramm oder 1 Mol) dieser Substanz an ihrem Schmelzpunkt zu schmelzen.
Zum Beispiel beträgt die Schmelzwärme für Wasser ungefähr 334 Joule pro Gramm (J/g). Das bedeutet, dass Sie 334 Joule Energie hinzufügen müssen, um 1 Gramm Eis bei 0°C zu 1 Gramm flüssigem Wasser bei 0°C zu schmelzen.
Die Physik hinter dem Schmelzen: sensible vs. latente Wärme
Ein häufiger Verwirrungspunkt ist, warum die Temperatur während des Schmelzens nicht ansteigt. Dies wird durch den Unterschied zwischen zwei Arten von Wärmeenergie erklärt.
Sensible Wärme
Sensible Wärme ist die Energie, die die Temperatur einer Substanz ändert. Wenn Sie sensible Wärme hinzufügen, erhöhen Sie die kinetische Energie der Moleküle, wodurch sie sich schneller bewegen, was wir als Temperaturanstieg messen. Die Formel dafür lautet q = m * c * ΔT.
Latente Wärme
Latente Wärme ist die Energie, die während eines Phasenübergangs bei konstanter Temperatur absorbiert oder freigesetzt wird. Während des Schmelzens wird die zugeführte Energie vollständig genutzt, um die intermolekularen Bindungen aufzubrechen, die das Kristallgitter des Festkörpers zusammenhalten, und ihn in eine Flüssigkeit zu überführen.
Da die Energie im Phasenübergang "verborgen" ist, anstatt einen Temperaturanstieg zu verursachen, wird sie als latent bezeichnet.
Häufige Fallstricke, die es zu vermeiden gilt
Die Anwendung des falschen Konzepts oder der falschen Formel ist eine häufige Fehlerquelle bei thermodynamischen Berechnungen. Achten Sie auf diese häufigen Fehler.
Verwechslung von Schmelzwärme mit spezifischer Wärme
Der häufigste Fehler ist die Verwendung der falschen Formel.
- Verwenden Sie
q = m * ΔH_f(Schmelzwärme) NUR für einen Phasenübergang bei konstanter Temperatur (z. B. Schmelzen von Eis bei 0°C). - Verwenden Sie
q = m * c * ΔT(Spezifische Wärme) NUR zur Temperaturänderung einer Substanz innerhalb einer einzigen Phase (z. B. Erhitzen von festem Eis von -10°C auf 0°C).
Nicht übereinstimmende Einheiten
Überprüfen Sie immer Ihre Einheiten. Wenn Ihre Masse (m) in Gramm angegeben ist, muss Ihre Schmelzwärme (ΔH_f) in Joule pro Gramm (J/g) angegeben sein. Wenn ΔH_f in Kilojoule pro Mol (kJ/mol) angegeben ist, müssen Sie zuerst die Masse Ihrer Probe in Mol umrechnen.
Ignorieren der Starttemperatur
Die Schmelzwärmegleichung gilt nur, wenn sich die Substanz bereits an ihrem Schmelzpunkt befindet. Wenn Sie einen Festkörper unterhalb seines Schmelzpunktes haben, müssen Sie eine zweistufige Berechnung durchführen:
- Berechnen Sie die Wärme, die benötigt wird, um den Festkörper auf seinen Schmelzpunkt zu erwärmen (
q = mcΔT). - Berechnen Sie die Wärme, die benötigt wird, um den Festkörper an seinem Schmelzpunkt zu schmelzen (
q = mΔH_f). - Addieren Sie die Ergebnisse für die insgesamt benötigte Wärme.
Anwendung der richtigen Formel für Ihre Berechnung
Um sicherzustellen, dass Sie Ihr Problem richtig lösen, identifizieren Sie den genauen Prozess, den Sie berechnen müssen.
- Wenn Ihr Hauptaugenmerk auf dem Schmelzen einer Substanz liegt, die sich bereits an ihrem Schmelzpunkt befindet: Sie benötigen nur die Schmelzwärmegleichung:
q = m * ΔH_f. - Wenn Ihr Hauptaugenmerk auf dem Erhitzen einer Substanz ohne Phasenänderung liegt: Sie benötigen nur die Gleichung für die spezifische Wärmekapazität:
q = m * c * ΔT. - Wenn Ihr Hauptaugenmerk auf dem Erhitzen eines Festkörpers und anschließendem vollständigen Schmelzen liegt: Sie müssen die Wärme für beide Schritte separat berechnen und addieren:
q_gesamt = (m * c * ΔT)_erhitzen + (m * ΔH_f)_schmelzen.
Das Verständnis, welchen physikalischen Prozess Sie modellieren, ist der Schlüssel zur Auswahl der richtigen Gleichung.
Zusammenfassungstabelle:
| Variable | Bedeutung | Gängige Einheiten | Wichtiger Punkt |
|---|---|---|---|
| q | Absorbierte Wärmeenergie | Joule (J), Kilojoule (kJ) | Gesamtenergie für den Phasenübergang |
| m | Masse der Substanz | Gramm (g), Mol (mol) | Muss mit den Einheiten von ΔH_f übereinstimmen |
| ΔH_f | Schmelzenthalpie | J/g, kJ/mol | Substanzspezifische Konstante (z. B. 334 J/g für Wasser) |
Benötigen Sie präzise Thermoanalysegeräte für Ihre Experimente?
Die genaue Berechnung des Wärmebedarfs ist in der Materialwissenschaft, Chemie und Pharmazie von grundlegender Bedeutung. KINTEK ist spezialisiert auf hochwertige Laborgeräte, einschließlich Kalorimeter und temperaturgeregelte Öfen, um sicherzustellen, dass Ihre thermischen Messungen zuverlässig und reproduzierbar sind.
Unsere Experten helfen Ihnen gerne bei der Auswahl der richtigen Werkzeuge für Ihre spezifische Anwendung, egal ob Sie Phasenübergänge, Materialsynthese oder Reaktionskinetik untersuchen.
Kontaktieren Sie noch heute unser technisches Team, um zu besprechen, wie KINTEK-Lösungen die Fähigkeiten Ihres Labors verbessern und Ihre Forschung optimieren können.
Visuelle Anleitung
Ähnliche Produkte
- Beheizte Hydraulische Pressmaschine mit integrierten manuellen Heizplatten für den Laboreinsatz
- 24T 30T 60T Beheizbare Hydraulische Pressmaschine mit Heizplatten für Labor-Heißpressen
- Zylindrische Labor-Elektroheizpresse Form für Laboranwendungen
- Automatische beheizte hydraulische Pressmaschine mit beheizten Platten für Labor-Heißpresse 25T 30T 50T
- Labor-Infrarot-Pressform
Andere fragen auch
- Wofür wird eine beheizte hydraulische Presse verwendet? Unverzichtbares Werkzeug zum Aushärten, Formen und Laminieren
- Was ist eine hydraulische Heißpresse? Ein Leitfaden für präzise Wärme und Druck in der Fertigung
- Wofür werden beheizte Hydraulikpressen verwendet? Formen von Verbundwerkstoffen, Vulkanisieren von Gummi und mehr
- Was ist eine hydraulische Heißpresse? Entfesseln Sie die Kraft von Hitze und Druck für fortschrittliche Materialien
- Was ist die Funktion einer Laborhydraulikpresse bei der Herstellung von Diamant/Ti-Verbundwerkstoffen? Gewährleistung atomarer Bindung


























