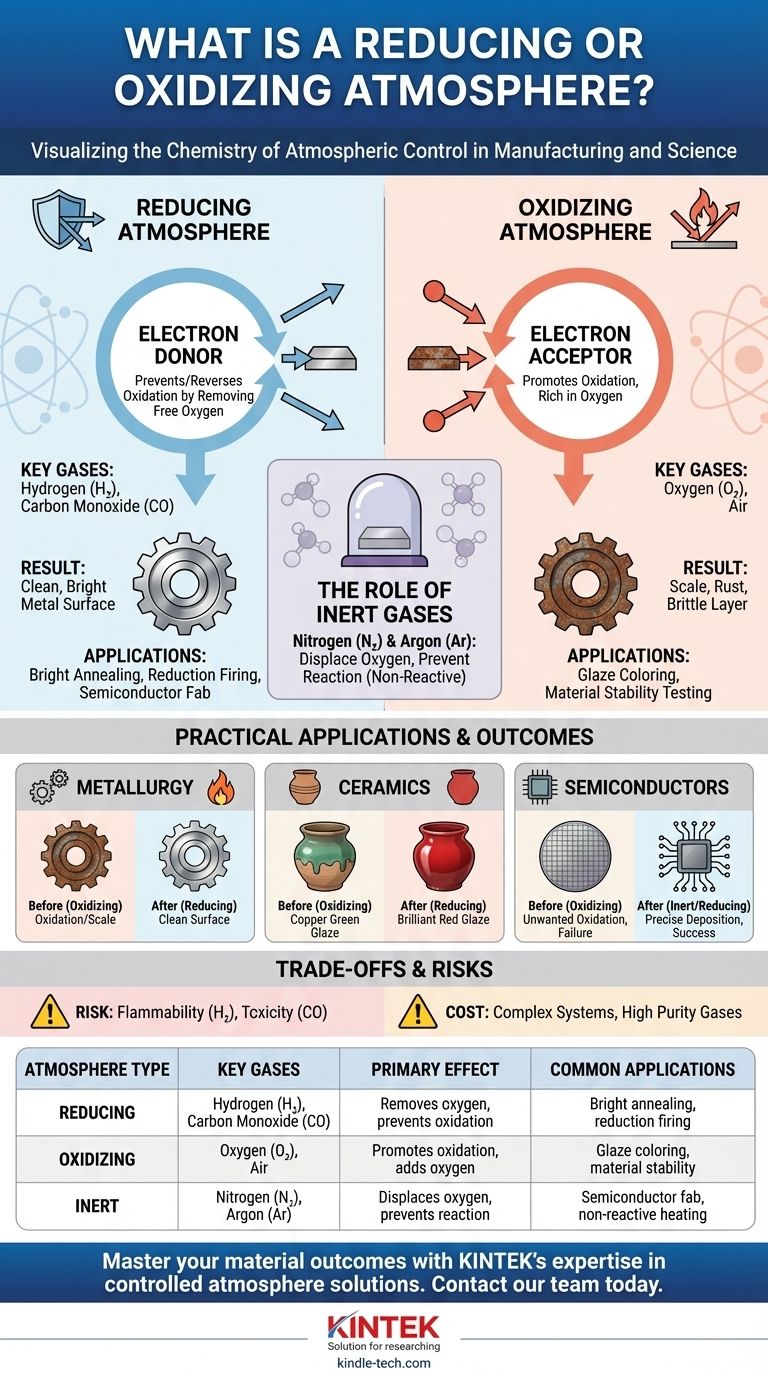
Im Wesentlichen ist eine reduzierende Atmosphäre eine Umgebung, die Oxidation verhindert oder umkehrt, typischerweise durch Entfernung von freiem Sauerstoff. Umgekehrt ist eine oxidierende Atmosphäre reich an Sauerstoff oder anderen Oxidationsmitteln und fördert aktiv die Oxidation. Diese kontrollierten Umgebungen sind nicht nur theoretische Konzepte; sie sind entscheidende Werkzeuge, die in der Fertigung und Wissenschaft eingesetzt werden, um die chemischen Eigenschaften von Materialien zu manipulieren.
Der Hauptunterschied liegt nicht nur in der Menge des vorhandenen Sauerstoffs, sondern im chemischen Potenzial der Atmosphäre. Eine reduzierende Atmosphäre ist ein Elektronendonor, der Materialien vor Oxidation schützt, während eine oxidierende Atmosphäre ein Elektronenakzeptor ist, der Materialien aktiv zur Oxidation bringt.

Die Chemie der Atmosphärenkontrolle
Um diese Atmosphären zu verstehen, müssen Sie zunächst die grundlegenden chemischen Prozesse verstehen, die sie steuern sollen: Oxidation und Reduktion. Diese beiden Prozesse treten immer zusammen in einer sogenannten „Redox“-Reaktion auf.
Oxidation: Die Tendenz, Elektronen abzugeben
Oxidation ist der Prozess, bei dem ein Material Elektronen verliert. Obwohl wir es mit Sauerstoff in Verbindung bringen, können auch andere Chemikalien Oxidation verursachen.
Das häufigste Beispiel ist Rost. Wenn Eisen einer oxidierenden Atmosphäre (wie der Luft um uns herum) ausgesetzt wird, verlieren die Eisenatome (Fe) Elektronen an Sauerstoffatome (O₂), wodurch Eisenoxid (Fe₂O₃) entsteht. Dies erzeugt eine spröde Schicht aus Zunder oder Rost auf der Oberfläche des Materials.
Reduktion: Die Tendenz, Elektronen aufzunehmen
Reduktion ist das genaue Gegenteil der Oxidation; es ist der Prozess, bei dem ein Material Elektronen aufnimmt.
Eine reduzierende Atmosphäre wird so konstruiert, dass sie reich an Molekülen ist, die leicht ihre Elektronen abgeben. Indem die Umgebung mit diesen „Elektronendonoren“ geflutet wird, wird effektiv verhindert, dass Sauerstoff Elektronen von dem Material „stiehlt“, das Sie schützen möchten.
Die Rolle der Schlüsselgase
Die spezifische Gasmischung bestimmt den Charakter der Atmosphäre.
- Oxidierende Gase: Das primäre oxidierende Gas ist Sauerstoff (O₂). Normale Luft ist eine mäßig oxidierende Atmosphäre.
- Reduzierende Gase: Wasserstoff (H₂) und Kohlenmonoxid (CO) sind starke Reduktionsmittel. Sie reagieren aggressiv mit jeglichem freien Sauerstoff und entfernen ihn aus der Umgebung, indem sie Wasser (H₂O) oder Kohlendioxid (CO₂) bilden.
- Inertgase: Stickstoff (N₂) und Argon (Ar) sind neutral. Sie reagieren normalerweise nicht mit Materialien. Ihr Hauptzweck ist die Verdrängung von Sauerstoff, wodurch eine inerte (nicht reaktive) Umgebung geschaffen wird, die Oxidation verhindert, ohne aktiv eine Reduktion zu verursachen.
Praktische Anwendungen: Wo die Atmosphäre alles ist
Die Kontrolle der Atmosphäre in einem Ofen, Brennofen oder Reaktor ist grundlegend, um das gewünschte Ergebnis in vielen industriellen und wissenschaftlichen Prozessen zu erzielen.
In der Metallurgie und Wärmebehandlung
Wenn Stahl für Prozesse wie das Glühen oder Härten auf hohe Temperaturen erhitzt wird, wird er hochreaktiv. Die Exposition gegenüber Luft würde zur Bildung einer dicken, spröden Schicht aus Oxidzunder auf seiner Oberfläche führen, was die Abmessungen und die Oberfläche des Teils ruiniert.
Durch die Durchführung der Wärmebehandlung in einer reduzierenden Atmosphäre aus Wasserstoff oder Stickstoff wird diese Oxidation vollständig verhindert, was zu einer sauberen, hellen Metalloberfläche führt.
Beim Brennen von Keramik und Töpferwaren
Die Atmosphäre hat einen dramatischen Einfluss auf die endgültige Farbe von Keramikglasuren, die Metalloxide enthalten.
In einer oxidierenden Atmosphäre verfärbt sich Kupferoxid in einer Glasur grün. In einer reduzierenden Atmosphäre wird der Sauerstoff jedoch vom Kupferoxid abgespalten, wodurch es wieder zu reinem, kolloidalem Kupfer reduziert wird, was zu einer brillanten roten Farbe führt. Dies ist die Grundlage des „Reduktionsbrandes“.
In der Halbleiterfertigung
Die Herstellung von Mikrochips erfordert Umgebungen von extremer Reinheit. Unerwünschte Oxidation kann isolierende Schichten dort erzeugen, wo leitende Bahnen benötigt werden, was zum Ausfall des Bauteils führt.
Fertigungsprozesse werden häufig in inerten (Argon) oder reduzierenden (Wasserstoff) Atmosphären durchgeführt, um die Siliziumwafer zu schützen und die präzise Abscheidung von Dünnschichten zu gewährleisten.
Verständnis der Kompromisse und Risiken
Obwohl sie wirkungsvoll sind, birgt die Schaffung und Aufrechterhaltung einer bestimmten Atmosphäre erhebliche Herausforderungen und Gefahren, die bewältigt werden müssen.
Die Gefahr reduzierender Gase
Die effektivsten reduzierenden Gase sind auch gefährlich. Wasserstoff (H₂) ist extrem entzündlich und kann über einen weiten Konzentrationsbereich in Luft explosiv sein.
Kohlenmonoxid (CO) ist ein farb-, geruchloses und hochgiftiges Gas, das ein ernstes Gesundheitsrisiko darstellt, falls es aus dem Ofen oder Brennofen austritt.
Die Kosten und Komplexität der Kontrolle
Die Aufrechterhaltung einer spezialisierten Atmosphäre ist nicht einfach. Sie erfordert einen abgedichteten Ofen oder Brennofen, eine zuverlässige Versorgung mit hochreinen Gasen, hochentwickelte Durchflusskontrollsysteme und Sensoren zur Überwachung der atmosphärischen Zusammensetzung. Dies erhöht die Kosten und die Komplexität jedes Prozesses erheblich.
Unbeabsichtigte Materialveränderungen
Die Verwendung der falschen Atmosphäre kann zerstörerisch sein. Eine oxidierende Atmosphäre kann ein Metallteil spröde und unbrauchbar machen. Eine stark reduzierende Atmosphäre kann Sauerstoff aus der chemischen Struktur bestimmter Keramiken ziehen und deren physikalische Eigenschaften auf unerwünschte Weise verändern.
Die richtige Wahl für Ihr Ziel treffen
Die Wahl der Atmosphäre wird vollständig durch das chemische Ergebnis bestimmt, das Sie erzielen möchten.
- Wenn Ihr Hauptaugenmerk darauf liegt, Oberflächenzunder auf Metallen zu verhindern: Sie benötigen eine reduzierende (Wasserstoff/CO) oder inerte (Stickstoff/Argon) Atmosphäre, um den Kontakt mit Sauerstoff während der Wärmebehandlung zu eliminieren.
- Wenn Ihr Hauptaugenmerk darauf liegt, bestimmte Glasurfarben in Keramiken zu erzielen: Sie müssen die Ofenatmosphäre aktiv zwischen oxidierenden und reduzierenden Bedingungen manipulieren, um den Endzustand der Metalloxide zu steuern.
- Wenn Ihr Hauptaugenmerk auf der Analyse der Stabilität eines Materials bei hohen Temperaturen liegt: Wahrscheinlich werden Sie es in einer oxidierenden Atmosphäre (Luft) testen, um seine realen Betriebsbedingungen zu simulieren.
- Wenn Ihr Hauptaugenmerk einfach auf dem Erhitzen eines nicht reaktiven Materials liegt: Eine Standard-oxidierende Atmosphäre (Luft) ist oft ausreichend und die einfachste und kostengünstigste Option.
Letztendlich ist die Beherrschung der atmosphärischen Bedingungen Ihres Prozesses gleichbedeutend mit der Beherrschung der endgültigen chemischen und physikalischen Eigenschaften Ihres Materials.
Zusammenfassungstabelle:
| Atmosphärenart | Schlüsselgase | Haupteffekt | Häufige Anwendungen |
|---|---|---|---|
| Reduzierend | Wasserstoff (H₂), Kohlenmonoxid (CO) | Entfernt Sauerstoff, verhindert Oxidation | Blankglühen von Metallen, Reduktionsbrand in der Keramik |
| Oxidierend | Sauerstoff (O₂), Luft | Fördert Oxidation, fügt Sauerstoff hinzu | Glasurfarben (z. B. Kupfergrün), Materialstabilitätsprüfungen |
| Inert | Stickstoff (N₂), Argon (Ar) | Verdrängt Sauerstoff, verhindert Reaktion | Halbleiterfertigung, Erhitzen nicht reaktiver Materialien |
Meistern Sie Ihre Materialergebnisse mit der Expertise von KINTEK für Lösungen mit kontrollierter Atmosphäre. Ob Sie Metalle wärmebehandeln, Keramiken brennen oder Halbleiter herstellen – die richtige Atmosphäre ist entscheidend für Ihren Erfolg. KINTEK ist spezialisiert auf die Bereitstellung der Laborgeräte und Verbrauchsmaterialien, die zur Schaffung und Aufrechterhaltung präziser reduzierender, oxidierender oder inerter Umgebungen erforderlich sind. Lassen Sie sich von unseren Experten helfen, den perfekten Ofen, das richtige Gassystem und die richtigen Steuerungen auszuwählen, um konsistente, qualitativ hochwertige Ergebnisse zu erzielen. Kontaktieren Sie unser Team noch heute, um Ihre spezifischen Laboranforderungen zu besprechen und sicherzustellen, dass Ihr Prozess ein Erfolg wird.
Visuelle Anleitung
Ähnliche Produkte
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- Vertikaler Labortiegelofen
Andere fragen auch
- Wie stellt ein Atmosphärenofen die Qualität bei der Synthese von BN-Nanoröhren sicher? Präzisionskontrolle für Tassenstapelstrukturen
- Welche Funktion hat eine Hochvakuum-Atmosphären-Ofen bei der Validierung von Wasserstoffdiffusionsmodellen? Stellen Sie reine Daten sicher.
- Wie arbeiten ein Quarzrohrreaktor und ein Atmosphärenofen bei der Co@NC-Pyrolyse zusammen? Meisterhafte Präzisionssynthese
- Warum wird Argon bei der Stahlherstellung verwendet? Für überlegenen Schutz, Reinheit und Leistung
- Welches Gas wird im Glühofen verwendet? Die Rolle von Wasserstoff beim Schutz Ihrer Materialien
- Welche Rolle spielen Hochtemperatur-Atmosphärenöfen bei der Vorbereitung von CrFe2MnNi-Legierungen? Beherrschung der mikrostrukturellen Stabilität
- Warum wird ein Röhrenatmosphärenofen für Kupfer-beschichteten Graphit benötigt? Sicherstellung einer oxidfreien Grenzflächenbindung
- Was ist ein Wasserstoffofen? Ermöglichen Sie eine oxidfreie Verarbeitung für überlegene Materialien



















