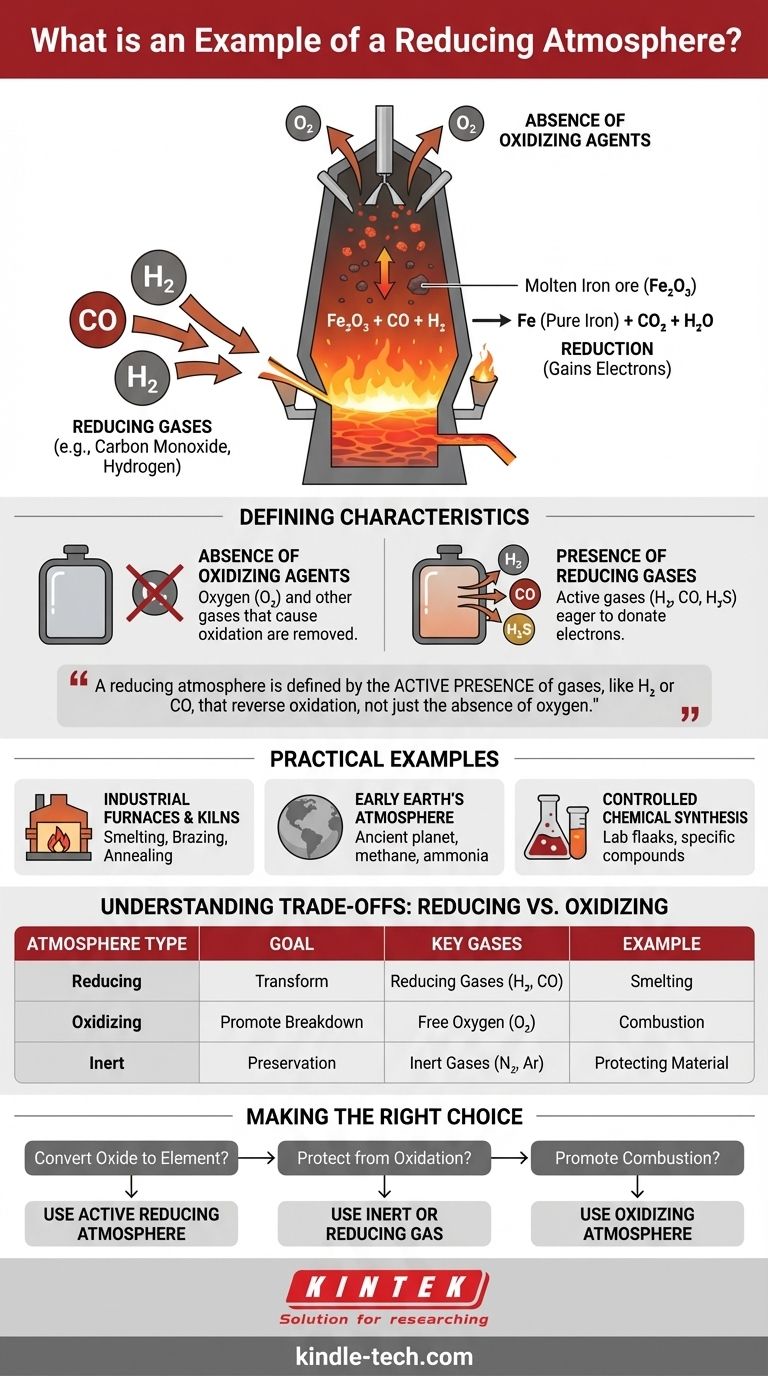
Ein klassisches Beispiel für eine reduzierende Atmosphäre ist die Umgebung in einem Hochofen, der zur Verhüttung von Eisenerz verwendet wird. Bei diesem Hochtemperaturprozess wird Sauerstoff gezielt entfernt und Kohlenmonoxid eingeleitet, wodurch eine Bedingung geschaffen wird, die Sauerstoffatome aktiv aus dem Eisenerz entfernt und es dadurch zu reinem, metallischem Eisen „reduziert“.
Die entscheidende Erkenntnis ist, dass eine reduzierende Atmosphäre nicht nur die Abwesenheit von Sauerstoff bedeutet; sie ist definiert durch die aktive Anwesenheit von Gasen, wie Wasserstoff oder Kohlenmonoxid, die chemisch dazu neigen, Elektronen abzugeben und den Prozess der Oxidation umzukehren.

Was definiert eine „reduzierende“ Atmosphäre?
Um das Konzept vollständig zu erfassen, ist es wichtig, seine beiden definierenden Merkmale zu verstehen: was abwesend ist und was vorhanden ist.
Die Abwesenheit von Oxidationsmitteln
Der erste Schritt zur Schaffung einer reduzierenden Atmosphäre ist die Entfernung von Sauerstoff und anderen Gasen, die Oxidation verursachen.
Unsere alltägliche Atmosphäre ist eine oxidierende Atmosphäre. Sie ist der Grund, warum ein Apfelschnitz braun wird und Eisen rostet. Diese Prozesse werden durch die Anwesenheit von freiem Sauerstoff angetrieben.
Die Anwesenheit reduzierender Gase
Eine echte reduzierende Atmosphäre enthält aktive Reduktionsmittel. Dies sind Gase, die chemisch instabil sind und begierig darauf, Elektronen an andere Substanzen abzugeben.
Häufige Beispiele sind Wasserstoff (H₂), Kohlenmonoxid (CO) und Schwefelwasserstoff (H₂S). Diese Gase suchen aktiv nach Sauerstoffatomen in anderen Materialien und binden sich an sie.
Die chemische Reaktion (Reduktion)
Diese Umgebung ermöglicht eine chemische Reaktion, die als Reduktion bezeichnet wird. In der Chemie findet eine Reduktion statt, wenn ein Atom oder Molekül Elektronen aufnimmt und somit seinen Oxidationszustand senkt.
Im Beispiel des Hochofens gibt das Kohlenmonoxid (CO) Elektronen an das Eisenoxid (Fe₂O₃) ab, das diese aufnimmt. Dadurch wird das Eisenerz zu elementarem Eisen (Fe) reduziert.
Praktische Beispiele in Natur und Industrie
Das Verständnis, wo diese Atmosphären vorkommen, hilft, das Konzept und seine Bedeutung zu festigen.
Industrielle Öfen und Schmelzanlagen
Das Schmelzen, Hartlöten und Glühen von Metallen wird oft in einer reduzierenden Atmosphäre durchgeführt. Dies verhindert die Bildung von Oxiden (Zunder oder Rost) auf der Metalloberfläche bei hohen Temperaturen und gewährleistet ein sauberes und stabiles Endprodukt.
Die Atmosphäre der frühen Erde
Vor Milliarden von Jahren, vor dem Aufkommen photosynthetischen Lebens, war die Erdatmosphäre von Natur aus reduzierend. Sie war reich an Gasen wie Methan, Ammoniak und Wasserdampf, enthielt aber praktisch keinen freien Sauerstoff.
Kontrollierte chemische Synthese
In Laboren und Chemieanlagen werden reduzierende Atmosphären erzeugt, um spezifische chemische Verbindungen herzustellen. Die kontrollierte Umgebung stellt sicher, dass nur die gewünschte Reduktionsreaktion ohne Störung durch unerwünschte Oxidation abläuft.
Die Abwägungen verstehen: Reduzierend vs. Oxidierend
Die Wahl zwischen der Schaffung einer reduzierenden, inerten oder oxidierenden Atmosphäre ist eine kritische technische Entscheidung, die vom gewünschten Ergebnis bestimmt wird. Die Abwägungen sind grundlegend.
Ziel: Umwandlung vs. Konservierung
Eine oxidierende Atmosphäre fördert den Zerfall (Rosten, Verbrennen). Eine reduzierende Atmosphäre fördert die Umwandlung durch die Entfernung von Sauerstoff aus Verbindungen. Eine inerte Atmosphäre (wie reines Argon) dient der Konservierung und verhindert, dass irgendeine Reaktion stattfindet.
Die Herausforderung von Sicherheit und Kontrolle
Reduzierende Atmosphären beinhalten oft Gase, die entweder brennbar (Wasserstoff) oder giftig (Kohlenmonoxid) sind. Die Aufrechterhaltung dieser Bedingungen, insbesondere bei hohen Temperaturen, erfordert hochentwickelte technische Kontrollen, um Sicherheit und Prozesseffizienz zu gewährleisten.
Kosten und Komplexität
Die Schaffung und Aufrechterhaltung einer spezifischen atmosphärischen Bedingung stellt eine zusätzliche Ebene der Komplexität und der Kosten dar. Für viele industrielle Prozesse ist diese Kontrolle jedoch nicht optional – sie ist der einzige Weg, das gewünschte Material herzustellen.
Die richtige Wahl für Ihr Ziel treffen
Ihr Verständnis der atmosphärischen Bedingungen sollte direkt mit dem chemischen Ziel verknüpft sein, das Sie erreichen möchten.
- Wenn Ihr Hauptaugenmerk auf der Umwandlung eines Oxids in sein reines Element liegt (z. B. Erz zu Metall): Sie benötigen eine aktive reduzierende Atmosphäre, die ein Gas wie Kohlenmonoxid oder Wasserstoff enthält.
- Wenn Ihr Hauptaugenmerk auf dem Schutz eines Materials vor Oberflächenoxidation während der Wärmebehandlung liegt: Sie müssen Sauerstoff verdrängen, was mit einem Inertgas (wie Stickstoff oder Argon) oder einem Reduktionsgas geschehen kann.
- Wenn Ihr Hauptaugenmerk auf der Verbrennung oder der Simulation der natürlichen Verwitterung liegt: Sie benötigen eine oxidierende Atmosphäre, insbesondere eine mit einer kontrollierten Menge an Sauerstoff.
Letztendlich wird die Art einer Atmosphäre durch die chemischen Reaktionen bestimmt, die sie fördert und welche sie verhindert.
Zusammenfassungstabelle:
| Merkmal | Reduzierende Atmosphäre | Oxidierende Atmosphäre |
|---|---|---|
| Hauptziel | Materialien umwandeln (z. B. Erz zu Metall) | Abbau fördern (z. B. Verbrennung, Rosten) |
| Wesentliche Abwesenheit | Freier Sauerstoff (O₂) | Nicht zutreffend |
| Wesentliche Anwesenheit | Reduzierende Gase (H₂, CO) | Freier Sauerstoff (O₂) |
| Beispielprozess | Eisengewinnung im Hochofen | Brennstoffverbrennung, natürliche Verwitterung |
Benötigen Sie eine präzise atmosphärische Kontrolle für Ihre Laborprozesse? KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien und bietet die Werkzeuge und das Fachwissen, um die exakte reduzierende, inerte oder oxidierende Umgebung zu schaffen und zu steuern, die Ihre Forschung oder Produktion erfordert. Sichern Sie die Reinheit und Qualität Ihrer Materialien – kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Rotationsrohrofen mit geteilter Mehrfachheizzone
Andere fragen auch
- Welche Rolle spielt ein Ofen mit kontrollierter Atmosphäre bei PIP? Hochfeste Keramikpyrolyse erreichen
- Welche Rolle spielt ein Schutzgasofen mit Argongasfluss bei der Herstellung von reduziertem Graphenoxid (rGO)?
- Warum wird Wasserstoff in Industrieöfen verwendet? Erzielung höchster Reinheit und glänzender Oberflächen
- Was ist die Atmosphäre eines Sinterofens? Der Schlüssel zur Präzisionswerkstofftechnik
- Welche Rolle spielen temperaturgesteuerte Öfen und Inertgas beim Heißtauch-Aluminieren? Beherrschen Sie die Beschichtungspräzision
- Was sind die Inertgase in einem Wärmebehandlungsofen? Wählen Sie den richtigen Schutz für Ihr Metall
- Welche Gase werden beim Hartlöten verwendet? Wichtige Erkenntnisse für starke, saubere Verbindungen
- Warum wird Stickstoff in Öfen verwendet? Wichtige Vorteile für Hochtemperaturprozesse



















