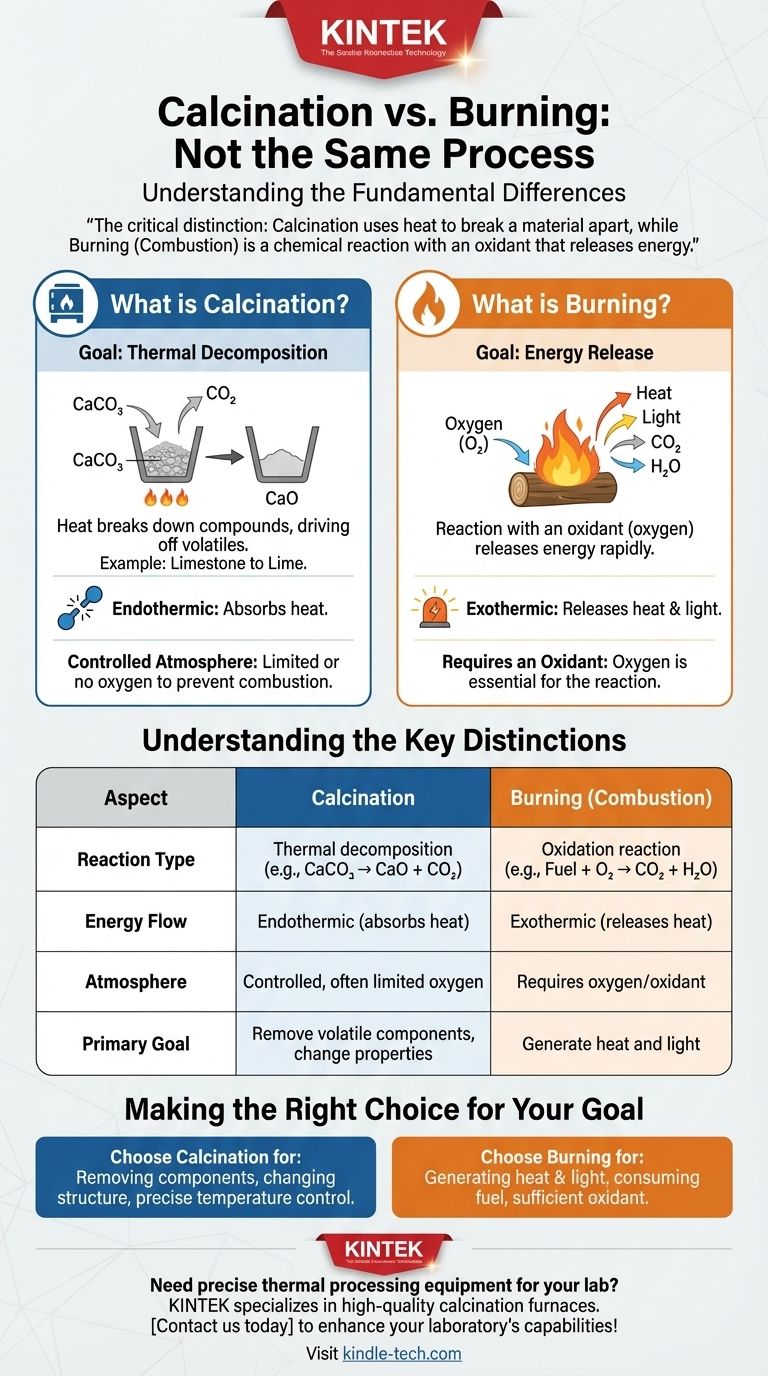
Entgegen einem weit verbreiteten Irrtum ist die Kalzinierung kein Verbrennungsprozess. Obwohl beide hohe Temperaturen beinhalten, handelt es sich um grundlegend unterschiedliche chemische Umwandlungen. Die Kalzinierung ist ein Prozess der thermischen Zersetzung, bei dem Wärme genutzt wird, um eine Verbindung aufzubrechen, oft um eine flüchtige Komponente wie Kohlendioxid oder Wasser auszutreiben.
Der entscheidende Unterschied ist dieser: Bei der Kalzinierung wird Wärme genutzt, um ein Material aufzuspalten, oft in einer kontrollierten Atmosphäre, während es sich bei der Verbrennung um eine chemische Reaktion mit einem Oxidationsmittel wie Sauerstoff handelt, die Energie freisetzt.

Was ist Kalzinierung?
Die Kalzinierung ist ein präzises thermisches Behandlungsverfahren, das zur Änderung der chemischen und physikalischen Eigenschaften eines Materials eingesetzt wird. Der Begriff leitet sich vom lateinischen Wort calcinare ab, was „Kalk brennen“ bedeutet.
Das Ziel: Thermische Zersetzung
Der Hauptzweck der Kalzinierung ist die Verursachung einer thermischen Zersetzung. Wärme liefert die Energie, die benötigt wird, um chemische Bindungen innerhalb einer Substanz aufzubrechen, wodurch sie sich in einfachere Bestandteile zerlegt.
Ein häufiges Beispiel: Kalkstein zu Kalk
Die Herstellung von Kalk aus Kalkstein ist das klassische Beispiel. Wenn Kalkstein (Kalziumkarbonat, CaCO₃) auf eine hohe Temperatur erhitzt wird, zersetzt er sich.
Dieser Prozess treibt Kohlendioxid (CO₂)-Gas aus und hinterlässt Kalk (Kalziumoxid, CaO), eine entscheidende Komponente in Zement und anderen Industriematerialien.
Die Rolle einer kontrollierten Atmosphäre
Entscheidend ist, dass die Kalzinierung oft in einer Atmosphäre mit begrenztem oder keinem Sauerstoff stattfindet. Dies geschieht gezielt, um eine Verbrennung zu verhindern und sicherzustellen, dass nur die gewünschte Zersetzungsreaktion abläuft.
Wie unterscheidet sich das von der Verbrennung?
Die Verbrennung, chemisch bekannt als Oxidation, ist eine exotherme Hochtemperaturreaktion zwischen einem Brennstoff und einem Oxidationsmittel, meist Sauerstoff aus der Luft.
Die Notwendigkeit eines Oxidationsmittels
Im Gegensatz zur Kalzinierung kann eine Verbrennung nicht ohne ein Oxidationsmittel stattfinden. Wenn Sie Holz verbrennen, zersetzen sich die organischen Verbindungen des Holzes nicht nur; sie reagieren aktiv mit Sauerstoff.
Das Ziel: Energieabgabe
Das Hauptergebnis der Verbrennung ist die schnelle Freisetzung von Energie in Form von Wärme und Licht. Obwohl dabei auch neue chemische Substanzen entstehen (wie Asche, Kohlendioxid und Wasserdampf), ist die Energieabgabe ihr definierendes Merkmal.
Die wichtigsten Unterschiede verstehen
Die Verwechslung dieser beiden Prozesse kann zu erheblichen Fehlern bei der Materialverarbeitung, Chemie und im Ingenieurwesen führen. Die Unterschiede sind klar und absolut.
Reaktionstyp
Kalzinierung ist eine Zersetzungsreaktion. Eine einzige Verbindung zerfällt in zwei oder mehr einfachere Produkte (z. B. CaCO₃ → CaO + CO₂).
Verbrennung ist eine Oxidationsreaktion. Ein Brennstoff reagiert mit einem Oxidationsmittel zu neuen, oxidierten Produkten (z. B. CH₄ + 2O₂ → CO₂ + 2H₂O).
Energiefluss
Die Kalzinierung ist typischerweise ein endothermer Prozess. Sie erfordert eine kontinuierliche Energiezufuhr (Wärme), um die Reaktion aufrechtzuerhalten und die chemischen Bindungen zu lösen.
Die Verbrennung ist ein exothermer Prozess. Sobald sie eingeleitet ist, setzt sie weitaus mehr Energie frei, als zu ihrem Start erforderlich war, wodurch eine selbsterhaltende Reaktion entsteht.
Die richtige Wahl für Ihr Ziel treffen
Zu verstehen, ob man kalzinieren oder verbrennen muss, ist grundlegend, um das gewünschte Ergebnis bei jedem thermischen Prozess zu erzielen.
- Wenn Ihr Hauptaugenmerk darauf liegt, eine bestimmte Komponente aus einem Feststoff zu entfernen (wie Wasser oder CO₂) oder dessen Kristallstruktur zu verändern: Sie führen eine Kalzinierung durch, bei der eine präzise Temperaturkontrolle und Atmosphärenmanagement von entscheidender Bedeutung sind.
- Wenn Ihr Hauptaugenmerk darauf liegt, durch den Verbrauch eines Brennstoffs Wärme und Licht zu erzeugen: Sie führen eine Verbrennung durch, bei der die Sicherstellung einer ausreichenden Zufuhr eines Oxidationsmittels wie Luft die Hauptpriorität ist.
Die Unterscheidung zwischen diesen beiden grundlegenden Prozessen ist für die Kontrolle chemischer Reaktionen und die effektive Konstruktion von Materialien unerlässlich.
Zusammenfassungstabelle:
| Aspekt | Kalzinierung | Verbrennung (Oxidation) |
|---|---|---|
| Reaktionstyp | Thermische Zersetzung | Oxidationsreaktion |
| Energiefluss | Endotherm (absorbiert Wärme) | Exotherm (gibt Wärme ab) |
| Atmosphäre | Kontrolliert, oft begrenzter Sauerstoff | Erfordert Sauerstoff/Oxidationsmittel |
| Hauptziel | Entfernung flüchtiger Bestandteile, Änderung der Materialeigenschaften | Erzeugung von Wärme und Licht |
Benötigen Sie präzise Geräte für die thermische Verarbeitung für Ihr Labor? KINTEK ist spezialisiert auf hochwertige Kalzinieröfen und Laborgeräte, die für die kontrollierte thermische Zersetzung entwickelt wurden. Unsere Lösungen gewährleisten eine genaue Temperaturkontrolle und Atmosphärenverwaltung für die Materialumwandlung. Kontaktieren Sie uns noch heute, um die Fähigkeiten Ihres Labors zu erweitern!
Visuelle Anleitung
Ähnliche Produkte
- Rotationsrohrofen mit geteilter Mehrfachheizzone
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Labor-Vakuum-Kipp-Drehrohröfen Drehrohröfen
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
- Labor-Schnelltemperatur-Prozess (RTP) Quarzrohr-Ofen
Andere fragen auch
- Was ist ein Rotationsretortenofen? Erzielen Sie überlegene Gleichmäßigkeit bei der kontinuierlichen Wärmebehandlung
- Welche Art von Kunststoff eignet sich am besten für die Pyrolyse? Maximieren Sie Ölausbeute und -qualität mit Polyolefinen
- Wie beeinflusst der Druck den Pyrolyseprozess? Steuerung der Produktausbeuten von Gas, Flüssigkeit und Koks
- Was sind die negativen Auswirkungen der Pyrolyse? Hohe Kosten und Umweltrisiken erklärt
- Ist Pyrolyse kostspielig? Die wahren wirtschaftlichen Grundlagen der Waste-to-Energy-Technologie entschlüsseln
- Welche Faktoren beeinflussen die Biokohleproduktion? Schlüsselvariablen zur Entwicklung von Biokohle für Ihre Anwendung
- Wie hoch ist die Temperatur des Drehrohrofens? Es hängt von der Heizmethode ab
- Welche Vorteile bietet die Pyrolyse von Kunststoffabfällen? Abfall in Brennstoff verwandeln und Deponievolumen reduzieren



















