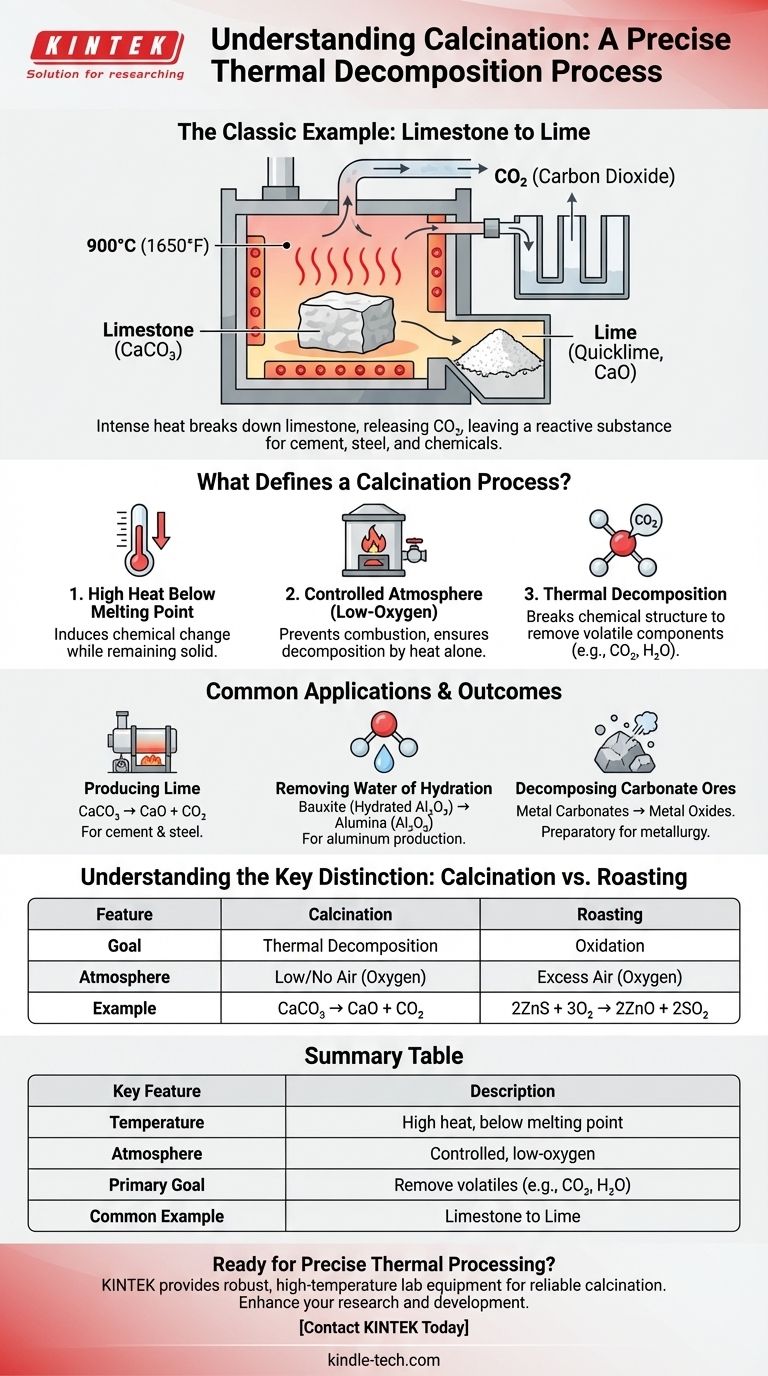
Das klassische Beispiel für Kalzinierung ist das Erhitzen von Kalkstein (Kalziumkarbonat) zur Herstellung von Kalk (Kalziumoxid). Bei diesem Prozess zersetzt die intensive Hitze den Kalkstein, wodurch er Kohlendioxidgas freisetzt und eine pulverförmige, reaktivere Substanz zurückbleibt. Dies ist ein grundlegender Prozess, der seit Jahrhunderten bei der Herstellung von Zement und anderen Industriematerialien verwendet wird.
Kalzinierung ist nicht bloßes Erhitzen; es ist ein präziser Prozess der thermischen Zersetzung. Er verwendet hohe Temperaturen unterhalb des Schmelzpunktes des Materials in einer kontrollierten, sauerstoffarmen Atmosphäre, um flüchtige Bestandteile wie Kohlendioxid oder Wasser zu entfernen.

Was definiert einen Kalzinierungsprozess?
Um die Kalzinierung wirklich zu identifizieren, muss man über die einfache Anwendung von Hitze hinausblicken. Drei spezifische Bedingungen definieren den Prozess und unterscheiden ihn von anderen Wärmebehandlungen wie Rösten oder Trocknen.
Die Rolle hoher Hitze
Bei der Kalzinierung wird ein fester Stoff auf eine sehr hohe Temperatur erhitzt. Entscheidend ist, dass diese Temperatur unterhalb des Schmelzpunkts des Materials gehalten wird.
Das Ziel ist es, eine chemische Veränderung oder Zersetzung herbeizuführen, während das Material in seinem festen Zustand verbleibt, wodurch es oft spröde oder porös wird.
Eine kontrollierte Atmosphäre
Der Prozess wird in Abwesenheit oder bei sehr begrenzter Zufuhr von Luft (Sauerstoff) durchgeführt. Dies ist ein wichtiges Unterscheidungsmerkmal zu anderen thermischen Prozessen.
Durch die Begrenzung des Sauerstoffs verhindert die Kalzinierung Verbrennung oder signifikante Oxidation. Das Hauptziel ist die Zersetzung, die allein durch Hitze und nicht durch Reaktion mit der Luft verursacht wird.
Das Ziel: Thermische Zersetzung
Der grundlegende Zweck der Kalzinierung besteht darin, die chemische Struktur einer Substanz aufzubrechen.
Diese Zersetzung führt zur Entfernung einer flüchtigen Komponente aus dem Feststoff. Der abgetriebene Teil ist typischerweise ein Gas, wie Kohlendioxid (CO2) aus Karbonaten oder Wasserdampf (H2O) aus hydratisierten Mineralien.
Häufige Anwendungen und Ergebnisse
Obwohl die Herstellung von Kalk das Lehrbuchbeispiel ist, wird die Kalzinierung in verschiedenen Industrien zur Umwandlung von Materialien eingesetzt.
Herstellung von Kalk aus Kalkstein
Dies ist das häufigste Beispiel. Kalkstein (CaCO₃) wird auf Temperaturen um 900 °C erhitzt. Er zersetzt sich zu Branntkalk (CaO) und setzt Kohlendioxidgas frei.
Dieser Kalk ist ein entscheidender Bestandteil bei der Herstellung von Zement, Stahl und bestimmten Chemikalien.
Entfernung von Hydratwasser
Die Kalzinierung wird häufig zur Entfernung chemisch gebundenen Wassers aus hydratisierten Mineralien eingesetzt.
Zum Beispiel wird Bauxiterz, eine hydratisierte Form von Aluminiumoxid, kalziniert, um Wasser auszutreiben und reines Aluminiumoxid (Al₂O₃) zu erzeugen, den primären Rohstoff für die Herstellung von Aluminiummetall.
Zersetzung von Karbonaterzen
Ähnlich wie bei Kalkstein werden andere Metallkarbonaterze kalziniert, um sie in ihre Oxidformen umzuwandeln.
Dies ist oft ein vorbereitender Schritt in der Metallurgie, da Metalloxide im Allgemeinen leichter zu reinem Metall reduziert werden können als ihre ursprünglichen Karbonatformen.
Verständnis der Schlüsselunterschiede
Ein häufiger Verwechslungspunkt ist die Unterscheidung zwischen Kalzinierung und einem ähnlichen Prozess, der als Rösten bekannt ist. Die Unterscheidung ist entscheidend und liegt vollständig im Ziel und der verwendeten Atmosphäre.
Kalzinierung vs. Rösten
Kalzinierung zielt auf thermische Zersetzung in Abwesenheit von Luft ab. Man kann es sich als das „Backen“ eines Minerals vorstellen, um es zu zersetzen. Ein Beispiel ist CaCO₃ → CaO + CO₂.
Rösten hingegen ist das Erhitzen eines Minerals in einem Überschuss an Luft (Sauerstoff). Das Ziel ist die Oxidation, oft um Sulfiderze in Oxide umzuwandeln. Ein Beispiel ist 2ZnS + 3O₂ → 2ZnO + 2SO₂.
Warum die Atmosphäre kontrollieren?
Die Begrenzung von Luft während der Kalzinierung ist unerlässlich, um unerwünschte Nebenreaktionen zu verhindern. Wenn beispielsweise beim Erhitzen von Kalkstein Sauerstoff vorhanden wäre, würde dies die Hauptreaktion nicht grundlegend verändern, aber bei anderen Materialien könnte es zu unerwünschter Oxidation führen.
Die Kontrolle der Atmosphäre stellt sicher, dass die thermische Zersetzung die vorherrschende und beabsichtigte Umwandlung ist.
Wie man einen Kalzinierungsprozess identifiziert
Basierend auf diesen Prinzipien können Sie leicht erkennen, ob ein Prozess ein Beispiel für Kalzinierung ist.
- Wenn Ihr Fokus auf der Zersetzung eines Karbonaterzes liegt: Das Erhitzen von Kalkstein, Dolomit oder anderen Karbonaten, um CO₂ auszutreiben und ein Oxid zu bilden, ist ein eindeutiges Beispiel für Kalzinierung.
- Wenn Ihr Fokus auf der Entfernung chemisch gebundenen Wassers liegt: Das Erhitzen eines hydratisierten Minerals wie Bauxit oder Gips zur Herstellung seiner wasserfreien Form ist eine weitere Hauptanwendung der Kalzinierung.
- Wenn der Schlüsselunterschied die Atmosphäre ist: Ein Prozess, bei dem ein Feststoff unterhalb seines Schmelzpunktes in wenig oder keiner Luft erhitzt wird, um einen chemischen Abbau zu bewirken, ist Kalzinierung.
Die Erkennung dieser Bedingungen ermöglicht es Ihnen, die Kalzinierung als ein grundlegendes Werkzeug der Chemie- und Werkstofftechnik zu unterscheiden.
Zusammenfassungstabelle:
| Hauptmerkmal | Beschreibung |
|---|---|
| Temperatur | Hohe Hitze, aber unterhalb des Schmelzpunkts des Materials. |
| Atmosphäre | Kontrollierte Umgebung mit geringem oder keinem Sauerstoffgehalt. |
| Hauptziel | Thermische Zersetzung zur Entfernung flüchtiger Bestandteile (z. B. CO₂, H₂O). |
| Häufiges Beispiel | Erhitzen von Kalkstein (CaCO₃) zur Herstellung von Kalk (CaO). |
Bereit für präzise thermische Verarbeitung in Ihrem Labor?
Die Kalzinierung ist ein fundamentaler Prozess zur Umwandlung von Materialien, von der Zersetzung von Karbonaten bis zur Dehydratisierung von Mineralien. KINTEK ist spezialisiert auf die Bereitstellung der robusten Hochtemperatur-Laborgeräte – wie fortschrittliche Öfen mit präziser Atmosphärenkontrolle –, die Sie benötigen, um diese Prozesse zuverlässig und sicher durchzuführen.
Ob Sie in der Materialwissenschaft, Metallurgie oder Chemieingenieurwesen tätig sind, unsere Lösungen sind darauf ausgelegt, die strengen Anforderungen Ihrer Forschung und Entwicklung zu erfüllen. Lassen Sie uns Ihnen helfen, die Fähigkeiten Ihres Labors zu erweitern.
Kontaktieren Sie KINTEK noch heute, um Ihre spezifischen Anforderungen an die thermische Verarbeitung zu besprechen und die richtige Ausrüstung für Ihre Anwendung zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Elektrische Drehrohrofen-Pyrolyseofenanlage Kalzinator Kleiner Drehrohrofen Rotierender Ofen
- Elektrischer Drehrohrofen Kontinuierlicher Betrieb Kleine Drehrohrofen Heizpyrolyseanlage
- Rotationsrohrofen mit geteilter Mehrfachheizzone
- Elektrischer Drehrohrofen Kleiner Drehrohrofen Biomasse-Pyrolyseanlage
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
Andere fragen auch
- Was ist der Zweck eines Kalzinators? Steigerung der Effizienz bei Hochtemperaturprozessen
- Was sind die Produkte der Pyrolyse von Holz? Ein Leitfaden zu den Ausbeuten an Biokohle, Bioöl und Synthesegas
- Welche Ausrüstung wird bei der Pyrolyse verwendet? Den richtigen Reaktor für Ihren Rohstoff und Ihre Produkte wählen
- Was sind die verschiedenen Reaktortypen bei der Kunststoffpyrolyse? Wählen Sie das richtige System für Ihren Abfall
- Was ist der Unterschied zwischen Kalzinieren und Rösten? Ein Leitfaden zur Hochtemperaturverarbeitung



















