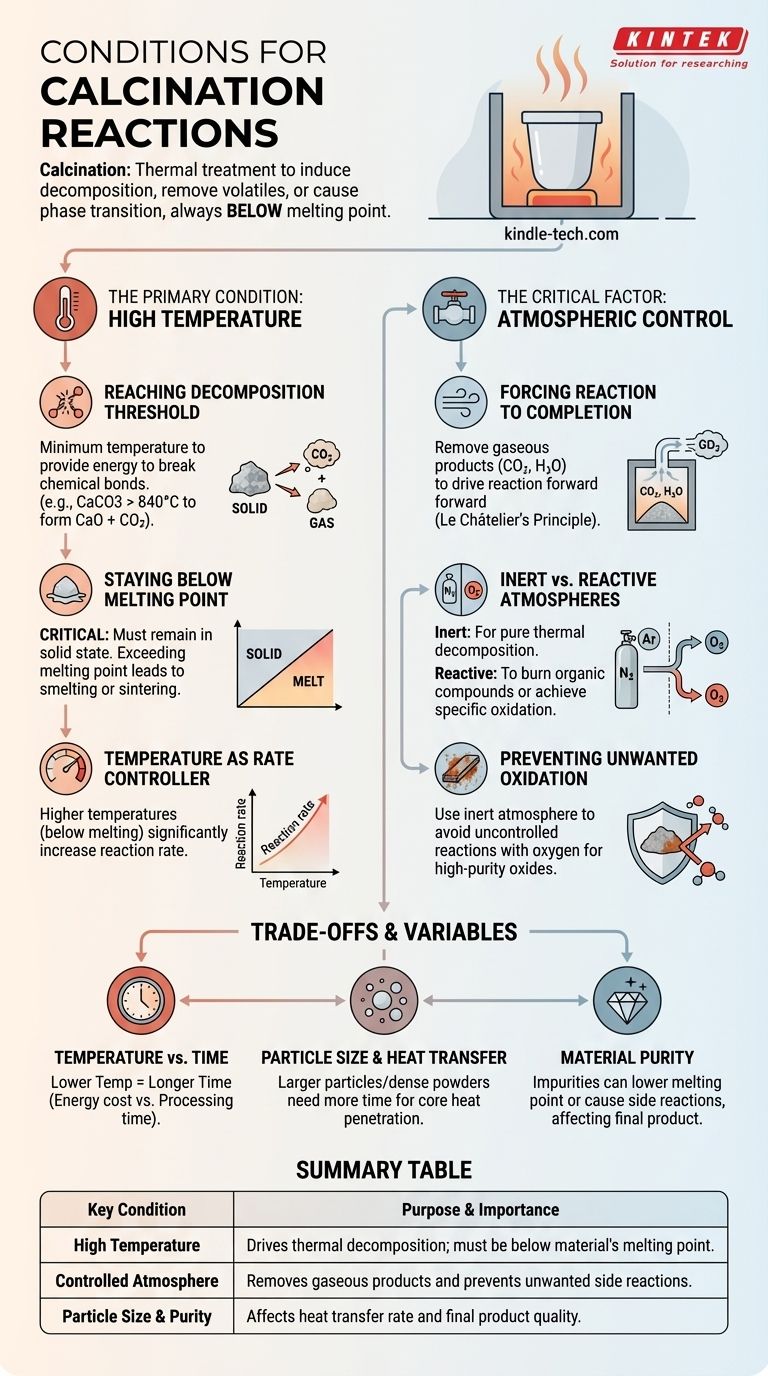
Kalzinierungsreaktionen werden durch hohe Temperaturen angetrieben, typischerweise unterhalb des Schmelzpunkts eines Materials, und finden in einer spezifisch kontrollierten Atmosphäre statt. Das Ziel ist die Auslösung der thermischen Zersetzung, die Entfernung flüchtiger Stoffe oder die Auslösung eines Phasenübergangs in einem festen Material, ohne es zu schmelzen.
Die Kalzinierung ist im Grunde ein thermischer Behandlungsprozess, bei dem ein Feststoff stark erhitzt wird, um eine spezifische chemische oder physikalische Veränderung zu bewirken. Der Erfolg hängt nicht nur vom Erreichen einer Zieltemperatur ab, sondern auch von der präzisen Kontrolle der umgebenden Atmosphäre, um die gewünschte Reaktion voranzutreiben und unerwünschte Nebenwirkungen zu verhindern.

Die Hauptbedingung: Hohe Temperatur
Die Anwendung von Wärme ist die grundlegendste Bedingung für die Kalzinierung. Der spezifische Temperaturbereich ist jedoch entscheidend und wird durch zwei gegensätzliche Einschränkungen bestimmt.
Erreichen der Zersetzungsschwelle
Jede Kalzinierungsreaktion hat eine Mindesttemperatur, die erforderlich ist, um die Energie für den Bruch chemischer Bindungen bereitzustellen. Beispielsweise muss Calciumcarbonat (Kalkstein) auf über 840 °C erhitzt werden, um seine Bindungsenergie zu überwinden und sich in Calciumoxid (Branntkalk) und Kohlendioxid zu zersetzen.
Unterhalb des Schmelzpunkts bleiben
Dies ist ein definierendes Merkmal der Kalzinierung. Der Prozess muss stattfinden, solange sich das Material im festen Zustand befindet. Wenn die Temperatur den Schmelzpunkt des Materials überschreitet, handelt es sich nicht mehr um Kalzinierung; es wird zu Schmelzen oder Sintern, was das Ergebnis und die Struktur des Produkts grundlegend verändert.
Temperatur als Ratenregler
Obwohl es eine Mindesttemperatur für die Zersetzung gibt, erhöht eine Erhöhung der Temperatur (während sie unterhalb des Schmelzpunkts bleibt) die Reaktionsgeschwindigkeit erheblich. Industrielle Prozesse laufen oft bei höheren Temperaturen ab, um sicherzustellen, dass die Reaktion schnell und effizient abläuft.
Der kritische Faktor: Atmosphärenkontrolle
Das Gas, das das Material während des Erhitzens umgibt, ist genauso wichtig wie die Temperatur selbst. Die Atmosphäre kann entweder ein passiver oder ein aktiver Teilnehmer an der Reaktion sein.
Die Reaktion zum Abschluss zwingen
Viele Kalzinierungsreaktionen setzen ein Gas frei, wie z. B. CO₂ oder H₂O. Nach dem Prinzip von Le Châtelier kann die Ansammlung dieses Gases die Reaktion verlangsamen oder sogar umkehren. Daher ist eine Schlüsselbedingung oft ein Luftstrom oder ein Vakuum, das das gasförmige Produkt kontinuierlich entfernt und so die Zersetzung zum Abschluss zwingt.
Inerte vs. Reaktive Atmosphären
Die Wahl der Atmosphäre verhindert unerwünschte Nebenreaktionen. Eine inerte Atmosphäre, wie Stickstoff oder Argon, wird verwendet, wenn das Ziel die reine thermische Zersetzung ohne Oxidation ist. Eine reaktive Atmosphäre, wie Luft oder reiner Sauerstoff, wird absichtlich verwendet, um organische Verbindungen abzubrennen oder einen spezifischen Oxidationszustand im Endmaterial zu erreichen.
Verhinderung unerwünschter Oxidation
Bei der Herstellung hochreiner Metalloxide kann das Erhitzen des Ausgangsmaterials in offener Luft zu unkontrollierten Reaktionen mit Sauerstoff führen. Die Verwendung einer inerten Atmosphäre stellt sicher, dass die einzige stattfindende Reaktion die beabsichtigte thermische Zersetzung ist, was zu einem reineren Produkt führt.
Verständnis der Kompromisse und Variablen
Das Erreichen der perfekten Kalzinierungsbedingungen erfordert ein Gleichgewicht zwischen mehreren konkurrierenden Faktoren.
Temperatur vs. Zeit
Eine niedrigere Temperatur kann immer noch eine Kalzinierung bewirken, dauert aber deutlich länger. Dies führt zu einem praktischen Kompromiss zwischen den Energiekosten für die Aufrechterhaltung hoher Temperaturen und der für eine vollständige Reaktion erforderlichen Prozesszeit.
Partikelgröße und Wärmeübertragung
Die Wärme muss in den Kern jedes Partikels eindringen, damit die Reaktion vollständig ist. Größere Partikel oder ein dicht gepacktes Pulver benötigen mehr Zeit, da die Wärmeübertragung zum Zentrum langsamer erfolgt. Unvollständige Kalzinierung ist ein häufiges Problem, das durch unzureichende Erhitzungszeit für die gegebene Partikelgröße verursacht wird.
Materialreinheit
Verunreinigungen im Ausgangsmaterial können erhebliche Auswirkungen haben. Sie können den Schmelzpunkt des Materials senken, was zu versehentlichem Sintern führt, oder unbeabsichtigte Nebenreaktionen verursachen, die das Endprodukt verunreinigen. Die Reinheit des Rohmaterials ist eine entscheidende Anfangsbedingung.
Die richtige Wahl für Ihr Ziel treffen
Die optimalen Kalzinierungsbedingungen hängen vollständig vom gewünschten Ergebnis ab.
- Wenn Ihr Hauptaugenmerk auf der Herstellung einer Massenchemikalie wie Kalk liegt: Die Hauptbedingungen sind eine Temperatur, die deutlich über dem Zersetzungspunkt liegt, und ein starker Luftstrom, um CO₂ effizient zu entfernen.
- Wenn Ihr Hauptaugenmerk auf der Aktivierung eines Katalysators oder Adsorbens liegt: Eine präzise Temperaturkontrolle und eine spezifische Atmosphäre (z. B. trockene Luft) sind entscheidend, um Wasser oder andere flüchtige Stoffe zu entfernen, ohne die empfindliche poröse Struktur des Materials zu zerstören.
- Wenn Ihr Hauptaugenmerk auf der Herstellung eines hochreinen Keramikpulvers liegt: Die Schlüsselbedingungen sind ein hochreines Ausgangsmaterial, eine präzise Temperaturkontrolle, um Sintern zu vermeiden, und eine auf die Verhinderung unerwünschter Oxidation abgestimmte Atmosphäre.
Letztendlich liegt die Beherrschung der Kalzinierung darin zu verstehen, dass Temperatur und Atmosphäre präzise Werkzeuge sind, um das chemische Schicksal eines Materials zu steuern.
Zusammenfassungstabelle:
| Schlüsselbedingung | Zweck & Bedeutung |
|---|---|
| Hohe Temperatur | Treibt die thermische Zersetzung an; muss unterhalb des Schmelzpunkts des Materials liegen. |
| Kontrollierte Atmosphäre | Entfernt gasförmige Produkte und verhindert unerwünschte Nebenreaktionen. |
| Partikelgröße & Reinheit | Beeinflusst die Geschwindigkeit der Wärmeübertragung und die Qualität des Endprodukts. |
Bereit, Ihren Kalzinierungsprozess zu perfektionieren? KINTEK ist spezialisiert auf Hochleistungslaboröfen und -geräte, die eine präzise Temperatur- und Atmosphärenkontrolle bieten. Ob Sie Katalysatoren entwickeln, Keramiken synthetisieren oder Mineralien verarbeiten – unsere Lösungen gewährleisten, dass Ihre Reaktionen effizient und wiederholbar sind. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir die spezifischen Kalzinierungsanforderungen Ihres Labors unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- Labor-Vakuum-Kipp-Drehrohröfen Drehrohröfen
- Rotationsrohrofen mit geteilter Mehrfachheizzone
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
- Labor-Schnelltemperatur-Prozess (RTP) Quarzrohr-Ofen
Andere fragen auch
- Was ist die Hauptfunktion eines industriellen Drehrohr-Ofens? Master Wolframpulver-Wasserstoffreduktion
- Was ist der Zweck der Vorbehandlung von Kohleproben? Sicherstellung genauer Pyrolyse durch Stickstofftrocknung
- Wie läuft die Zirkoniumproduktion ab? Vom Erz zum Hochleistungsmetall & zur Keramik
- Was ist ein Drehrohrofen? Der ultimative Leitfaden für gleichmäßige Erwärmung & Mischung
- Welche Vorteile bietet ein Drehrohrofen? Erzielen Sie überragende Homogenität & Effizienz für Pulver & Granulate



















