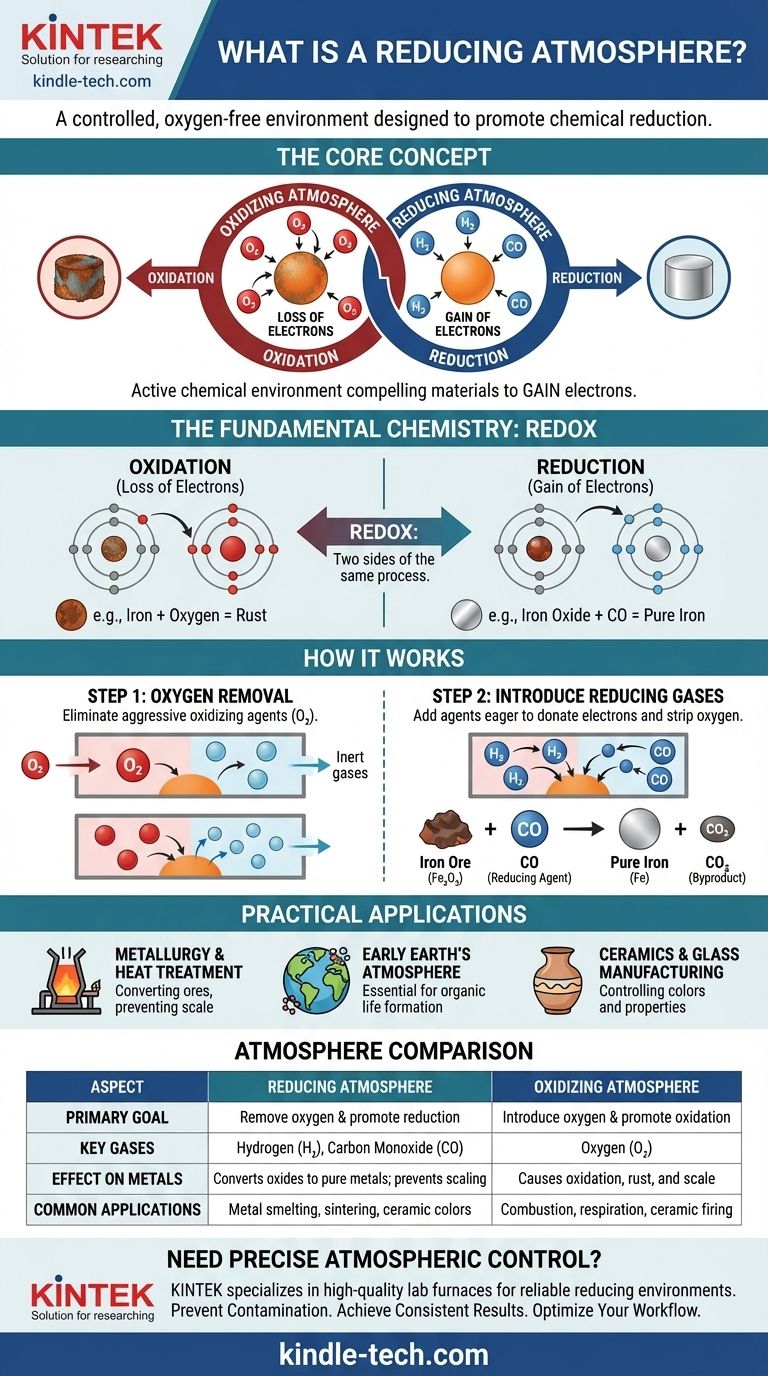
Kurz gesagt, eine reduzierende Atmosphäre ist eine kontrollierte gasförmige Umgebung, in der Sauerstoff absichtlich entfernt und durch Gase ersetzt wurde, die Oxidation verhindern und die chemische Reduktion aktiv fördern. Diese Art von Atmosphäre ist reich an „Reduktionsmitteln“ wie Wasserstoff (H₂), Kohlenmonoxid (CO) oder Schwefelwasserstoff (H₂S), die chemisch bereit sind, Elektronen abzugeben und Sauerstoff von anderen Materialien zu entfernen.
Eine reduzierende Atmosphäre ist nicht nur die Abwesenheit von Sauerstoff; sie ist eine aktive chemische Umgebung, die darauf ausgelegt ist, eine spezifische Reaktion zu erzwingen. Sie funktioniert, indem sie einen Überschuss an Elektronen erzeugt, der Materialien dazu zwingt, diese Elektronen aufzunehmen und in einen weniger oxidierten Zustand zurückzukehren.

Die grundlegende Chemie im Spiel
Um eine reduzierende Atmosphäre wirklich zu verstehen, müssen Sie zunächst das grundlegende chemische Prinzip verstehen, auf dem sie basiert: Oxidation und Reduktion. Dies sind zwei Seiten derselben Medaille, ein Prozess, der oft als „Redox“ bezeichnet wird.
Oxidation und Reduktion verstehen
Oxidation ist der Verlust von Elektronen. Ein klassisches Beispiel ist das Rosten von Eisen. Sauerstoff in der Luft entzieht den Eisenatomen Elektronen und bildet Eisenoxid (Rost). Das Eisen wird „oxidiert“.
Reduktion ist die Aufnahme von Elektronen. Sie ist das chemische Gegenteil der Oxidation. Eine reduzierende Atmosphäre erleichtert diesen Prozess, indem sie eine Umgebung schafft, in der Atome gezwungen sind, Elektronen aufzunehmen.
Stellen Sie es sich wie ein chemisches Tauziehen um Elektronen vor. Ein Oxidationsmittel, wie Sauerstoff, ist stark und zieht Elektronen von anderen Materialien weg. Ein Reduktionsmittel, wie Wasserstoff, ist großzügig und spendet Elektronen an andere Materialien.
Die Rolle der Sauerstoffentfernung
Der erste und wichtigste Schritt bei der Schaffung einer reduzierenden Atmosphäre ist die Entfernung von freiem Sauerstoff (O₂) und anderen oxidierenden Gasen.
Sauerstoff ist ein hochaggressives Oxidationsmittel. Seine Anwesenheit macht es nahezu unmöglich, eine Reduktionsreaktion durchzuführen, da er unerbittlich Elektronen aus jeder verfügbaren Quelle ziehen wird. Seine Entfernung verhindert, dass diese unerwünschte Oxidation auftritt.
Die Funktion von reduzierenden Gasen
Die bloße Entfernung von Sauerstoff erzeugt eine neutrale oder inerte Atmosphäre. Um sie zu einer reduzierenden Atmosphäre zu machen, werden spezifische Gase eingeführt.
Diese Gase – typischerweise Wasserstoff (H₂) oder Kohlenmonoxid (CO) – wirken als starke Reduktionsmittel. Sie haben eine stärkere Affinität zu Sauerstoff als viele andere Elemente, was bedeutet, dass sie aktiv Sauerstoffatome aus Verbindungen wie Metalloxiden „stehlen“.
Wenn beispielsweise Eisenerz (Eisenoxid, Fe₂O₃) in einem Ofen mit Kohlenmonoxid erhitzt wird, entzieht das CO dem Eisen den Sauerstoff, wodurch reines flüssiges Eisen zurückbleibt und Kohlendioxid (CO₂) als Nebenprodukt entsteht. Das Eisenerz wurde zu Eisen „reduziert“.
Praktische Anwendungen und Kontext
Reduzierende Atmosphären sind nicht nur ein theoretisches Konzept; sie sind ein kritisches Werkzeug in vielen industriellen und wissenschaftlichen Prozessen, wo eine präzise chemische Kontrolle notwendig ist.
Metallurgie und Wärmebehandlung
Dies ist die häufigste Anwendung. Hochöfen verwenden eine reduzierende Atmosphäre, die reich an Kohlenmonoxid ist, um Metallerze in reine Metalle umzuwandeln. Sie wird auch beim Glühen und Sintern verwendet, um die Bildung von Oxiden (Zunder) auf der Oberfläche von Metallen während der Hochtemperaturverarbeitung zu verhindern.
Die Atmosphäre der frühen Erde
Wissenschaftler vermuten, dass die ursprüngliche Atmosphäre der Erde eine reduzierende war, die Methan, Ammoniak und Wasserdampf enthielt, aber praktisch keinen freien Sauerstoff. Diese Umgebung war wesentlich für die Bildung der komplexen organischen Moleküle, die schließlich zum Leben führten.
Keramik- und Glasherstellung
Die Atmosphäre in einem Brennofen hat einen tiefgreifenden Einfluss auf das Endprodukt. Eine reduzierende Atmosphäre kann verwendet werden, um spezifische Farben und Eigenschaften in Keramikglasuren und Glas zu erzeugen, indem der Oxidationszustand der als Farbstoffe verwendeten Metalloxide verändert wird. Zum Beispiel erzeugt Kupferoxid in einem oxidierenden Brand Grün, aber in einem reduzierenden Brand ein tiefes Rot.
Die Kompromisse verstehen: Oxidierend vs. Reduzierend
Das Gegenteil einer reduzierenden Atmosphäre ist eine oxidierende Atmosphäre, die reich an Sauerstoff ist. Die aktuelle Atmosphäre unseres Planeten ist ein Paradebeispiel.
Die oxidierende Atmosphäre
Eine oxidierende Atmosphäre fördert den Verlust von Elektronen. Sie ist wesentlich für Prozesse wie die Verbrennung und die Zellatmung, aber in anderen Kontexten destruktiv, da sie Korrosion, Verderb und Abbau verursacht.
Warum Atmosphärenkontrolle kritisch ist
Die Wahl zwischen einer reduzierenden, inerten oder oxidierenden Atmosphäre wird vollständig durch das gewünschte Ergebnis bestimmt. Die Verwendung der falschen ist nicht nur ineffizient; sie kann für einen Prozess katastrophal sein.
Der Versuch, Metall in einer sauerstoffreichen Umgebung zu schmelzen, würde fehlschlagen und stattdessen mehr Oxide und Zunder produzieren. Umgekehrt würde das Brennen einer Keramik, die Oxidation erfordert, in einer reduzierenden Atmosphäre zu falschen und unvorhersehbaren Farben führen.
Dieses Wissen anwenden
Das Verständnis des Zwecks einer spezifischen Atmosphäre hängt davon ab, die gewünschte chemische Umwandlung zu identifizieren.
- Wenn das Hauptziel die Verhinderung von Degradation ist: Eine inerte oder reduzierende Atmosphäre wird verwendet, um Sauerstoff, den Hauptverursacher von Korrosion und Anlaufen, zu entfernen.
- Wenn das Hauptziel die Umwandlung eines Materials von einem Oxid in seine reine Form ist: Eine reduzierende Atmosphäre ist erforderlich, um aktiv Sauerstoffatome aus dem Material zu entfernen (z.B. Erz in Metall umzuwandeln).
- Wenn das Hauptziel die Kontrolle der Endprodukteigenschaften einer Verbindung ist: Das Gleichgewicht zwischen Oxidation und Reduktion wird verwendet, um den Elektronenzustand von Elementen zu manipulieren und dadurch Ergebnisse wie Farbe in Keramiken oder Leitfähigkeit in Halbleitern zu steuern.
Letztendlich ist das Wissen, ob eine Atmosphäre Elektronen spenden oder aufnehmen soll, der Schlüssel zur Vorhersage und Kontrolle chemischer Ergebnisse.
Zusammenfassungstabelle:
| Aspekt | Reduzierende Atmosphäre | Oxidierende Atmosphäre |
|---|---|---|
| Primäres Ziel | Sauerstoff entfernen & Reduktion fördern (Elektronenaufnahme) | Sauerstoff zuführen & Oxidation fördern (Elektronenverlust) |
| Schlüsselgase | Wasserstoff (H₂), Kohlenmonoxid (CO) | Sauerstoff (O₂) |
| Auswirkung auf Metalle | Wandelt Metalloxide in reine Metalle um; verhindert Zunderbildung | Verursacht Oxidation, führt zu Rost und Zunder |
| Häufige Anwendungen | Metallschmelzen, Glühen, Sintern, spezifische Keramikglasuren | Verbrennung, Atmung, Brennen bestimmter Keramiken |
Benötigen Sie präzise Atmosphärenkontrolle für Ihre Laborprozesse?
Ob Sie Metalle sintern, spezialisierte Keramikglasuren entwickeln oder Forschung betreiben, die eine sauerstofffreie Umgebung erfordert, die richtige Ausrüstung ist entscheidend. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laboröfen und Reaktoren, die für präzise Atmosphärenkontrolle ausgelegt sind, einschließlich der Schaffung zuverlässiger reduzierender Umgebungen.
Wir helfen Ihnen dabei:
- Kontamination verhindern: Stellen Sie sicher, dass Ihre Materialien nicht durch unerwünschte Oxidation degradiert werden.
- Konsistente Ergebnisse erzielen: Erhalten Sie die präzisen chemischen Umwandlungen, die Sie benötigen, Charge für Charge.
- Ihren Arbeitsablauf optimieren: Mit Geräten, die auf Zuverlässigkeit und Benutzerfreundlichkeit ausgelegt sind.
Bereit, die Fähigkeiten Ihres Labors zu verbessern? Kontaktieren Sie KINTEK noch heute, um Ihre spezifischen Laboranforderungen zu besprechen und wie unsere Lösungen Ihren Erfolg fördern können.
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Rotationsrohrofen mit geteilter Mehrfachheizzone
Andere fragen auch
- Kann Stickstoffgas erhitzt werden? Nutzen Sie die inerte Hitze für Präzision und Sicherheit
- Wie erzeugt man eine inerte Atmosphäre? Beherrschen Sie sichere, reine Prozesse durch Inertisierung
- Welche Gase werden in inerten Atmosphären verwendet? Wählen Sie das richtige Gas für nicht-reaktive Umgebungen
- Was ist ein inerter Zustand? Ein Leitfaden zur Vermeidung von Bränden und Explosionen
- Was ist eine Wärmebehandlung unter inerter Atmosphäre? Schützen Sie Ihre Metalle vor Oxidation & Entkohlung



















