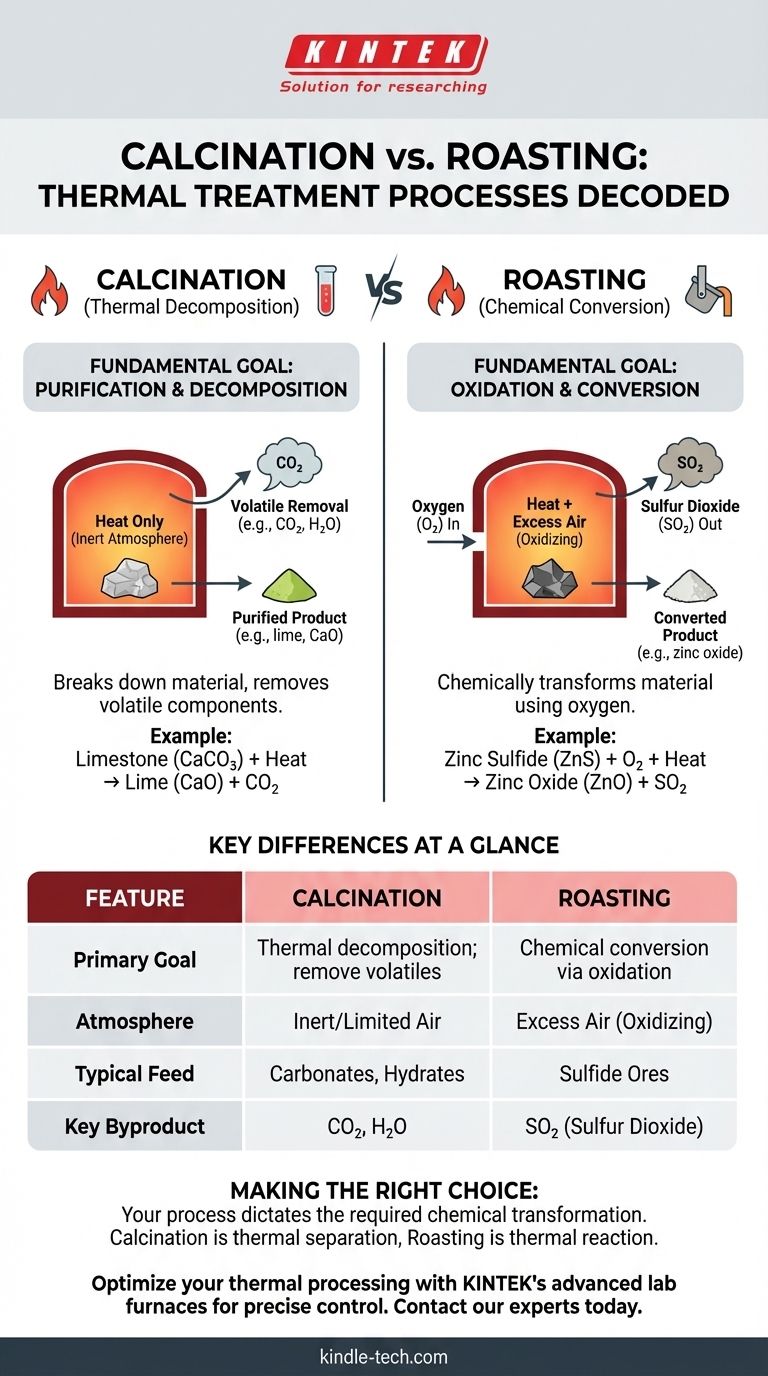
Im Grunde genommen liegt der Unterschied zwischen Kalzinierung und Röstung in der chemischen Rolle der Ofenatmosphäre. Die Kalzinierung ist ein Prozess der thermischen Zersetzung, der in Abwesenheit oder bei begrenzter Zufuhr von Luft durchgeführt wird, um flüchtige Stoffe auszutreiben. Im Gegensatz dazu ist die Röstung ein chemischer Umwandlungsprozess, der in einem Überschuss an Luft durchgeführt wird, um ein Material, meist ein Metallsulfiderz, gezielt zu oxidieren.
Stellen Sie es sich so vor: Bei der Kalzinierung wird Hitze verwendet, um eine Substanz zu zersetzen und einen Teil davon zu entfernen, wie das Austreiben von Wasser aus einem nassen Feststoff. Bei der Röstung werden Hitze und Luft verwendet, um die gesamte Substanz chemisch in etwas Neues umzuwandeln, wie die Umwandlung eines Sulfids in ein Oxid.

Die Prozesse dekonstruieren: Kalzinierung
Die Kalzinierung ist ein Reinigungsschritt und ein Zersetzungsschritt, der rein durch Hitze angetrieben wird. Das Ziel ist es, das Material durch Entfernung einer flüchtigen Komponente in eine stabilere oder wünschenswertere Form zu überführen.
Das grundlegende Ziel: Thermische Zersetzung
Das Hauptziel der Kalzinierung ist die Einleitung der thermischen Zersetzung. Das bedeutet, hohe Temperaturen zu nutzen, um chemische Bindungen aufzubrechen und einen bestimmten Teil der Verbindung als Gas freizusetzen.
Ein klassisches Beispiel ist die Herstellung von Kalk (Calciumoxid) aus Kalkstein (Calciumcarbonat). Hitze zersetzt das Carbonat und setzt Kohlendioxid frei.
CaCO₃ (fest) + Hitze → CaO (fest) + CO₂ (gasförmig)
Die entscheidende Rolle der Atmosphäre
Die Kalzinierung wird durch ihre Atmosphäre definiert, die entweder inert oder stark luftarm (sauerstoffarm) ist. Dies ist entscheidend, da das Ziel darin besteht, eine Oxidation oder andere unerwünschte Reaktionen mit der Ofenumgebung zu verhindern.
Der Prozess konzentriert sich ausschließlich darauf, was die Hitze mit dem Material selbst bewirken kann.
Häufige Anwendungen der Kalzinierung
Sie werden die Kalzinierung bei der Aufbereitung von Rohstoffen antreffen. Ihre Anwendungen umfassen das Entfernen von Wasser aus Hydraten (wie bei der Bauxitverarbeitung), das Entfernen von Kohlendioxid aus Carbonaten oder das Austreiben flüchtiger organischer Stoffe aus verschiedenen Substanzen.
Die Prozesse dekonstruieren: Röstung
Die Röstung ist ein metallurgisches Verfahren, das darauf abzielt, Metallerze chemisch zu verändern, um sie für nachfolgende Schritte wie das Schmelzen leichter verarbeitbar zu machen. Es handelt sich im Grunde um eine Reaktion mit Sauerstoff.
Das grundlegende Ziel: Chemische Umwandlung durch Oxidation
Das Ziel der Röstung ist die Oxidation. Bei diesem Prozess reagiert das Einsatzmaterial, typischerweise ein Metallsulfiderz, gezielt mit Sauerstoff aus der Luft.
Dadurch wird das Metallsulfid in ein Metalloxid umgewandelt, das in einer späteren Stufe leichter zu reinem Metall reduziert werden kann.
2ZnS (fest) + 3O₂ (gasförmig) + Hitze → 2ZnO (fest) + 2SO₂ (gasförmig)
Die entscheidende Rolle der Atmosphäre
Die Röstung erfordert eine oxidierende Atmosphäre, was bedeutet, dass ein Überschuss an Luft oder Sauerstoff in den Ofen geleitet wird. Sauerstoff ist nicht nur die Umgebung; er ist ein primärer Reaktant in diesem Prozess.
Ohne ausreichenden Sauerstoff kann die beabsichtigte chemische Umwandlung von Sulfid zu Oxid nicht stattfinden.
Häufige Anwendungen der Röstung
Die Röstung ist ein Eckpfeiler der metallurgischen Gewinnung. Sie ist die Hauptmethode zur Aufbereitung von Sulfiderzen von Metallen wie Zink, Blei, Kupfer und Nickel für das Schmelzen.
Hauptunterschiede im Überblick
Die Wahl zwischen Kalzinierung und Röstung hängt von Ihrem Ausgangsmaterial und Ihrem gewünschten Endprodukt ab. Es handelt sich um unterschiedliche Werkzeuge für unterschiedliche chemische Ziele.
Zweck
Die Kalzinierung zielt darauf ab, ein Material zu zersetzen und eine flüchtige Komponente (z. B. H₂O, CO₂) auszutreiben.
Die Röstung zielt darauf ab, ein Material durch Oxidation chemisch umzuwandeln (z. B. die Umwandlung eines Metallsulfids in ein Metalloxid).
Atmosphärische Bedingungen
Die Kalzinierung findet in einer inerten, reduzierenden oder sauerstoffarmen Atmosphäre statt, um eine Oxidation zu verhindern.
Die Röstung findet in einer oxidierenden Atmosphäre mit einem Luftüberschuss statt, um die Oxidation zu fördern.
Einsatzmaterialien
Die Kalzinierung wird typischerweise bei Hydraten, Carbonaten und Materialien mit flüchtigen organischen Bestandteilen angewendet.
Die Röstung wird überwiegend bei Sulfiderzen eingesetzt.
Gasförmige Nebenprodukte
Die Kalzinierung erzeugt hauptsächlich ungiftige Gase wie Kohlendioxid (CO₂) und Wasserdampf (H₂O).
Die Röstung erzeugt Schwefeldioxid (SO₂), ein erhebliches Schadstoffproblem, das aufgefangen und oft in Schwefelsäure umgewandelt werden muss, um Umweltschäden zu vermeiden.
Die richtige Wahl für Ihr Ziel treffen
Ihre Prozessauswahl wird ausschließlich durch die chemische Transformation bestimmt, die Sie erreichen müssen.
- Wenn Ihr Hauptaugenmerk darauf liegt, Kalk aus Kalkstein herzustellen: Sie müssen die Kalzinierung verwenden, um CO₂ ohne andere Reaktionen auszutreiben.
- Wenn Ihr Hauptaugenmerk darauf liegt, Zinksulfiderz für das Schmelzen vorzubereiten: Sie müssen rösten, um das Sulfid (ZnS) in Zinkoxid (ZnO) umzuwandeln.
- Wenn Ihr Hauptaugenmerk darauf liegt, Wasser aus einem Mineral zu entfernen: Sie benötigen eine Kalzinierung, um das H₂O schonend auszutreiben, ohne das Basismaterial zu verändern.
- Wenn Ihr Hauptaugenmerk darauf liegt, einen Oxid-Ausgangsstoff aus einem Sulfiderz zu erzeugen: Die Röstung ist der wesentliche erste Schritt in Ihrem metallurgischen Fließschema.
Letztendlich ist die Unterscheidung einfach: Kalzinierung ist eine thermische Trennung, während Röstung eine thermische Reaktion ist.
Zusammenfassungstabelle:
| Merkmal | Kalzinierung | Röstung |
|---|---|---|
| Hauptziel | Thermische Zersetzung; Entfernung flüchtiger Stoffe | Chemische Umwandlung durch Oxidation |
| Atmosphäre | Inert oder begrenzte Luft (sauerstoffarm) | Luftüberschuss (oxidierend) |
| Typisches Einsatzmaterial | Carbonate (z. B. Kalkstein), Hydrate | Sulfiderze (z. B. Zinksulfid) |
| Wichtigstes Nebenprodukt | CO₂, H₂O (Wasserdampf) | SO₂ (Schwefeldioxid) |
Bereit, Ihre thermische Verarbeitung zu optimieren?
Ob Ihr Ziel eine präzise thermische Zersetzung oder eine kontrollierte Oxidation ist, die fortschrittlichen Laboröfen von KINTEK bieten die exakte atmosphärische Kontrolle und Temperaturuniformität, die Sie benötigen. Unsere Geräte sind auf Zuverlässigkeit und Präzision in anspruchsvollen Anwendungen wie Materialreinigung und extraktiver Metallurgie ausgelegt.
Lassen Sie KINTEK Ihr Partner im Labor sein. Wir sind spezialisiert auf die langlebigen Hochleistungsausrüstungen, auf die Forschungs- und Qualitätskontrolllabore angewiesen sind.
Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Anforderungen an die thermische Behandlung zu besprechen und die perfekte Lösung für Ihren Prozess zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Elektrische Drehrohrofen-Pyrolyseofenanlage Kalzinator Kleiner Drehrohrofen Rotierender Ofen
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Elektrischer Drehrohrofen Kontinuierlicher Betrieb Kleine Drehrohrofen Heizpyrolyseanlage
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
- Kammerofen mit Bandförderer für kontrollierte Atmosphäre
Andere fragen auch
- Welche Biomasse wird bei der Pyrolyse verwendet? Auswahl des optimalen Rohstoffs für Ihre Ziele
- Was sind die verschiedenen Reaktortypen bei der Kunststoffpyrolyse? Wählen Sie das richtige System für Ihren Abfall
- Was ist das Prinzip des Drehrohrofens? Beherrschen der kontinuierlichen thermischen Verarbeitung
- Was ist der Zweck eines Kalzinators? Steigerung der Effizienz bei Hochtemperaturprozessen
- Was ist der Unterschied zwischen Kalzinieren und Rösten? Ein Leitfaden zur Hochtemperaturverarbeitung



















