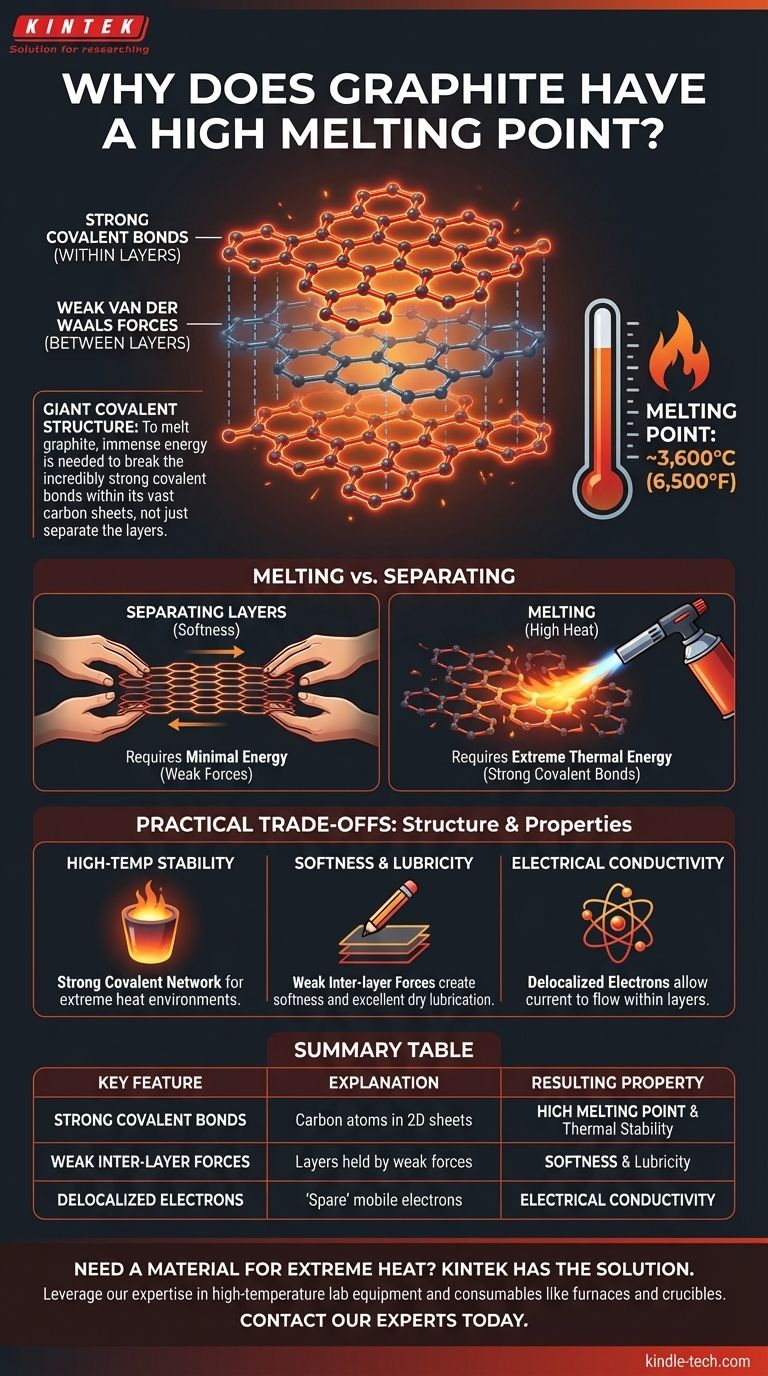
Im Kern ist der außergewöhnlich hohe Schmelzpunkt von Graphit (etwa 3.600 °C oder 6.500 °F) ein direktes Ergebnis seiner Atomstruktur. Um Graphit zu schmelzen, muss eine enorme Energiemenge aufgewendet werden, um die unglaublich starken kovalenten Bindungen zu brechen, die seine Kohlenstoffatome zu riesigen, zweidimensionalen Schichten verbinden.
Die entscheidende Erkenntnis ist, dass Graphit eine riesige kovalente Struktur ist. Ihn zu schmelzen bedeutet nicht einfach, seine Schichten auseinanderzuschieben; es bedeutet, das starke Netzwerk von Kohlenstoff-Kohlenstoff-Bindungen innerhalb dieser Schichten auseinanderzureißen, ein Prozess, der extreme thermische Energie erfordert.

Die zweidimensionale Architektur von Graphit
Um den hohen Schmelzpunkt zu verstehen, muss man zuerst die zwei unterschiedlichen Bindungsarten von Graphit visualisieren, die ihm eine einzigartige Kombination von Eigenschaften verleihen.
Die starken kovalenten Schichten
Graphit besteht aus unzähligen Schichten von Kohlenstoffatomen. Innerhalb jeder einzelnen Schicht ist jedes Kohlenstoffatom durch starke kovalente Bindungen mit drei weiteren Kohlenstoffatomen verbunden.
Diese Atome ordnen sich in einem wabenartigen Muster aus miteinander verbundenen hexagonalen Ringen an. Dies erzeugt eine riesige, flache und außergewöhnlich stabile Schicht, die als Graphen bekannt ist.
Die schwachen Kräfte zwischen den Schichten
Während die Bindungen innerhalb einer Schicht immens stark sind, sind die Kräfte, die die verschiedenen Schichten zusammenhalten, sehr schwach.
Diese Kräfte werden als Van-der-Waals-Kräfte bezeichnet. Sie lassen sich leicht überwinden, was es den Schichten ermöglicht, mit minimalem Aufwand aneinander vorbeizugleiten. Dies verleiht Graphit seine charakteristische Weichheit und macht es zu einem ausgezeichneten Trockenschmiermittel.
Warum diese Struktur extreme Hitze erfordert
Der Schlüssel zum hohen Schmelzpunkt von Graphit liegt im Verständnis dessen, was "Schmelzen" bei einer riesigen kovalenten Struktur tatsächlich bedeutet.
Schmelzen vs. Trennen
Das Schmelzen einer Substanz erfordert das Brechen der Bindungen, die ihre Atome oder Moleküle in einem festen Gitter halten, sodass sie sich frei als Flüssigkeit bewegen können.
Bei Graphit geht es bei diesem Prozess nicht darum, die schwachen Van-der-Waals-Kräfte zwischen den Schichten zu überwinden. Es geht darum, genügend Energie zuzuführen, um die starken kovalenten Bindungen innerhalb der Schichten selbst zu brechen.
Die schiere Energie kovalenter Bindungen
Kovalente Bindungen, bei denen Atome Elektronen teilen, gehören zu den stärksten chemischen Bindungsformen. Jede Kohlenstoff-Kohlenstoff-Bindung in Graphit ist außergewöhnlich stabil und erfordert einen massiven Input an thermischer Energie, um sie zu durchtrennen.
Da ein Stück Graphit eine kolossale Anzahl dieser Bindungen enthält, ist eine extrem hohe Temperatur erforderlich, um genügend davon zu brechen, damit die gesamte Struktur in einen flüssigen Zustand übergeht.
Verständnis der praktischen Kompromisse
Die duale Bindungsnatur von Graphit schafft ein Material der Kontraste. Seine Eigenschaften hängen stark davon ab, welcher Aspekt seiner Struktur getestet wird.
Hochtemperaturbeständigkeit
Das Netzwerk starker kovalenter Bindungen macht Graphit zu einem der thermisch stabilsten bekannten Materialien. Deshalb wird es für Anwendungen wie industrielle Tiegel zum Schmelzen von Metallen und als Auskleidung für Hochtemperaturöfen verwendet.
Mechanische Weichheit und Schmierung
Umgekehrt machen die schwachen Kräfte zwischen den Schichten Graphit mechanisch weich und zu einem ausgezeichneten Schmiermittel. Die Schichten lassen sich leicht abschälen, was das Prinzip dahinter ist, warum ein Graphitstift eine Markierung auf Papier hinterlässt.
Elektrische Leitfähigkeit
Die gleiche Bindungsstruktur, die thermische Stabilität verleiht, ermöglicht es Graphit auch, Elektrizität zu leiten. Jedes Kohlenstoffatom verfügt über ein „überschüssiges“ delokalisiertes Elektron, das sich frei entlang der Ebene der Schicht bewegen kann und so den Stromfluss ermöglicht. Dies ist eine seltene Eigenschaft für ein Nichtmetall.
Anwendung auf Ihr Ziel
Das Verständnis dieser Struktur-Eigenschafts-Beziehung ist der Schlüssel zur Auswahl des richtigen Materials für eine Anwendung.
- Wenn Ihr Hauptaugenmerk auf Hitzebeständigkeit liegt: Das riesige kovalente Netzwerk von Graphit macht es zur ersten Wahl für Hochtemperaturanwendungen, bei denen die strukturelle Integrität unter Hitze von größter Bedeutung ist.
- Wenn Ihr Hauptaugenmerk auf Schmierung oder Weichheit liegt: Die schwachen Kräfte zwischen den Schichten sind die Schlüsseleigenschaft und machen Graphit ideal für Trockenschmiermittel oder Schreibgeräte.
- Wenn Ihr Hauptaugenmerk auf elektrischer Leitfähigkeit in einem leichten Material liegt: Die beweglichen Elektronen von Graphit bieten eine leitfähige Lösung ohne das Gewicht der meisten Metalle.
Letztendlich ist der hohe Schmelzpunkt von Graphit eine direkte Folge der immensen Stärke der chemischen Bindungen, die seine grundlegende Struktur zusammenhalten.
Zusammenfassungstabelle:
| Wesentliches Merkmal | Erklärung | Resultierende Eigenschaft |
|---|---|---|
| Starke kovalente Bindungen | Kohlenstoffatome bilden starke kovalente Bindungen in 2D-Schichten (Graphen). | Hoher Schmelzpunkt & Thermische Stabilität |
| Schwache Kräfte zwischen den Schichten | Schichten werden durch schwache Van-der-Waals-Kräfte zusammengehalten. | Weichheit & Schmierung |
| Delokalisierte Elektronen | „Überschüssige“ Elektronen können sich frei innerhalb der Schichten bewegen. | Elektrische Leitfähigkeit |
Benötigen Sie ein Material für extreme Hitze? KINTEK hat die Lösung.
Das Verständnis der Eigenschaften von Materialien wie Graphit ist entscheidend für die Auswahl der richtigen Ausrüstung für Ihr Labor. Ob Sie Hochtemperaturöfen mit Graphitelementen, langlebige Tiegel oder andere Laborgeräte benötigen, die extremen Bedingungen standhalten, die Expertise von KINTEK ist Ihr Vorteil.
Wir sind spezialisiert auf die Bereitstellung zuverlässiger Laborgeräte und Verbrauchsmaterialien, die die einzigartigen Eigenschaften fortschrittlicher Materialien nutzen. Lassen Sie uns Ihnen helfen, Präzision und Haltbarkeit in Ihren Hochtemperaturanwendungen zu erreichen.
Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen Ihre spezifischen Laboranforderungen erfüllen können.
Visuelle Anleitung
Ähnliche Produkte
- Großer vertikaler Graphit-Vakuumgraphitierungs-Ofen
- Graphit-Vakuum-Durchlaufgraphitierungsöfen
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Graphit-Vakuumofen mit Bodenentleerung für Kohlenstoffmaterialien
- Graphitierungs-Vakuumofen für ultrahohe Temperaturen
Andere fragen auch
- Welche Rolle spielen Hochtemperaturöfen bei der SOFC-Synthese? Präzisionswerkzeuge für die Optimierung von Elektrolyten und Elektroden
- Bedeutet eine höhere Wärmekapazität einen höheren Schmelzpunkt? Der entscheidende Unterschied wird enthüllt
- Was sind die Herausforderungen bei der großflächigen Nutzung von Biomasseenergie? Die verborgenen Hürden einer grünen Energiequelle
- Wie trägt ein Hochtemperatur-Muffelofen zur nachträglichen Wärmebehandlung von Fe-Cr-Mn-Mo-N-C-Verbundwerkstoffen bei?
- Was ist die thermische Eigenschaft von Graphit? Beherrschung des extremen Wärmemanagements



















