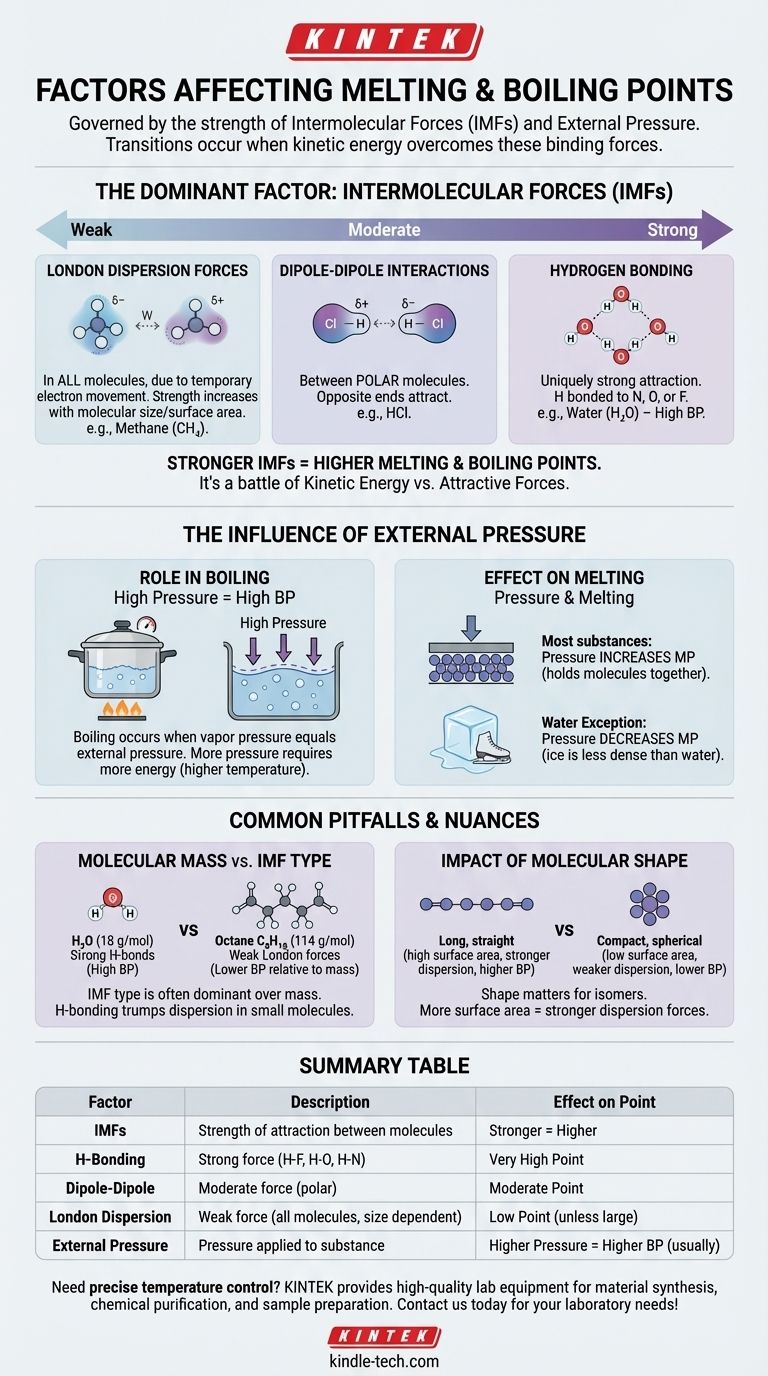
Auf fundamentaler Ebene werden der Schmelz- und Siedepunkt einer Substanz durch zwei Hauptfaktoren bestimmt: die Stärke der intermolekularen Kräfte (IMFs), die ihre Moleküle zusammenhalten, und den äußeren Druck, der auf sie ausgeübt wird. Im Wesentlichen finden diese Übergänge statt, wenn Moleküle genügend Energie gewinnen, um die Kräfte zu überwinden, die sie binden, und den Druck, der sie zurückhält.
Die Kernbotschaft ist, dass Schmelzen und Sieden nicht nur von der Temperatur abhängen; sie sind ein physikalischer Kampf zwischen der kinetischen Energie eines Moleküls und den anziehenden Kräften, die es an seine Nachbarn binden. Je stärker diese Anziehungen sind, desto mehr Energie ist erforderlich, um sie aufzubrechen.

Der dominierende Faktor: Intermolekulare Kräfte (IMFs)
Der wichtigste Einzelfaktor bei der Bestimmung des Schmelz- und Siedepunkts einer Substanz ist die Stärke der Anziehungskräfte zwischen ihren einzelnen Molekülen. Dies sind nicht die starken kovalenten Bindungen innerhalb eines Moleküls, sondern die schwächeren Kräfte, die dazu führen, dass Moleküle aneinander haften.
Was sind intermolekulare Kräfte?
Stellen Sie sich IMFs als das molekulare Äquivalent von Magneten vor. Einige Moleküle sind wie starke Elektromagnete, während andere wie schwache Kühlschrankmagnete sind. Um dieses „Klebrigkeit“ zu überwinden, ist Energie in Form von Wärme erforderlich.
Die Hierarchie der Kräfte
Intermolekulare Kräfte variieren in ihrer Stärke und bilden eine klare Hierarchie. Das Verständnis dieser Hierarchie ist der Schlüssel zur Vorhersage, welche Substanzen höhere oder niedrigere Siedepunkte haben werden.
Wasserstoffbrückenbindung (die stärkste) Dies ist eine einzigartig starke Art der Anziehung, die auftritt, wenn Wasserstoff an ein stark elektronegatives Atom wie Stickstoff (N), Sauerstoff (O) oder Fluor (F) gebunden ist. Wasser (H₂O) ist das klassische Beispiel, und seine starken Wasserstoffbrückenbindungen sind der Grund, warum es für seine geringe Größe einen bemerkenswert hohen Siedepunkt hat.
Dipol-Dipol-Wechselwirkungen (mäßig) Diese Kräfte existieren zwischen polaren Molekülen – Molekülen, die an einem Ende eine permanente Teilladung positiv und am anderen Ende eine Teilladung negativ haben. Diese entgegengesetzten Enden ziehen sich gegenseitig an und halten die Substanz mäßig gut zusammen.
London-Dispersionskräfte (die schwächsten) Diese Kräfte existieren in allen Molekülen und werden durch die vorübergehende, zufällige Bewegung von Elektronen verursacht, die flüchtige Dipole erzeugt. Obwohl sie einzeln schwach sind, werden sie mit zunehmender Größe und Oberfläche des Moleküls bedeutender. Deshalb sind größere Moleküle wie Octan (C₈H₁₈) bei Raumtemperatur Flüssigkeiten, während kleinere wie Methan (CH₄) Gase sind.
Der Einfluss des äußeren Drucks
Der äußere Druck wirkt wie ein physischer Deckel auf eine Substanz und erschwert es den Molekülen, in die nächste Phase zu entweichen (von fest zu flüssig oder von flüssig zu gasförmig).
Die Rolle des Drucks beim Sieden
Sieden tritt ein, wenn der innere Dampfdruck einer Flüssigkeit dem äußeren atmosphärischen Druck entspricht.
Wenn Sie den äußeren Druck erhöhen (z. B. in einem Schnellkochtopf), erhöhen Sie den Siedepunkt, da die Moleküle mehr Energie benötigen, um dieser stärkeren äußeren Kraft entgegenzuwirken.
Umgekehrt, wenn Sie den äußeren Druck verringern (z. B. durch das Aufsuchen großer Höhen), senken Sie den Siedepunkt. Deshalb siedet Wasser in Denver bei einer niedrigeren Temperatur als auf Meereshöhe.
Die Auswirkung des Drucks auf das Schmelzen
Bei den meisten Substanzen erhöht die Druckerhöhung den Schmelzpunkt leicht. Dies liegt daran, dass der Druck hilft, die Moleküle in der starren, dicht gepackten Struktur eines Festkörpers zu halten.
Wasser ist eine berühmte Ausnahme. Da festes Eis eine geringere Dichte als flüssiges Wasser hat, macht es das Anlegen von Druck tatsächlich einfacher zu schmelzen. Deshalb kann die Kufe eines Eisläufers über das Eis gleiten.
Häufige Fallstricke und Nuancen
Sich nur auf einen Faktor zu konzentrieren, kann irreführend sein. Das Zusammenspiel von Kräften, Masse und Form erzeugt wichtige Nuancen.
Molekularmasse vs. Intermolekulare Kraft
Obwohl die Siedepunkte im Allgemeinen mit der Molmasse zunehmen, ist die Art der IMF weitaus dominanter.
Ein kleines Molekül mit starken Wasserstoffbrückenbindungen, wie Wasser (18 g/mol, Siedepunkt 100°C), hat einen weitaus höheren Siedepunkt als ein Molekül ähnlicher Größe mit nur schwachen Dispersionskräften, wie Methan (16 g/mol, Siedepunkt -161,5°C).
Der Einfluss der Molekülform
Bei Molekülen mit der gleichen chemischen Formel (Isomere) spielt die Form eine Rolle. Lange, gerade Moleküle haben eine größere Oberfläche für den Kontakt, was zu stärkeren London-Dispersionskräften und höheren Siedepunkten führt.
Kompakte, kugelförmige Moleküle haben eine geringere Oberfläche und somit schwächere Anziehungskräfte und niedrigere Siedepunkte.
Die richtige Vorhersage treffen
Durch die Kombination dieser Prinzipien können Sie genau einschätzen, warum sich verschiedene Substanzen so verhalten, wie sie es tun.
- Wenn Ihr Hauptaugenmerk auf dem Vergleich verschiedener Substanzen liegt: Identifizieren Sie zuerst die stärkste intermolekulare Kraft, die in jeder vorhanden ist; dies wird fast immer der Hauptbestimmungsfaktor für ihre relativen Siedepunkte sein.
- Wenn Ihr Hauptaugenmerk auf der Änderung der Bedingungen einer Substanz liegt: Analysieren Sie, wie sich Änderungen des äußeren Drucks auf die für einen Phasenübergang erforderliche Energie auswirken, insbesondere beim Sieden.
- Wenn Sie auf ein unerwartetes Ergebnis stoßen: Berücksichtigen Sie sekundäre Faktoren wie die Molekülform oder die einzigartigen Dichte-Eigenschaften der Substanz, wie bei Wasser zu beobachten.
Indem Sie diese Grundprinzipien verstehen, können Sie von der bloßen Auswendiglernen von Schmelz- und Siedepunkten dazu übergehen, das physikalische Verhalten von Materie wirklich zu begreifen.
Zusammenfassungstabelle:
| Faktor | Beschreibung | Auswirkung auf Schmelz-/Siedepunkt |
|---|---|---|
| Intermolekulare Kräfte (IMFs) | Stärke der Anziehung zwischen Molekülen. | Stärkere Kräfte = Höherer Punkt |
| Wasserstoffbrückenbindung | Starke Kraft bei H-F-, H-O-, H-N-Bindungen. | Sehr hoher Punkt |
| Dipol-Dipol | Mäßige Kraft zwischen polaren Molekülen. | Mäßiger Punkt |
| London-Dispersion | Schwache Kraft in allen Molekülen, nimmt mit der Größe zu. | Niedriger Punkt (es sei denn, das Molekül ist groß) |
| Äußerer Druck | Auf die Substanz ausgeübter Druck. | Höherer Druck = Höherer Siedepunkt (normalerweise) |
Benötigen Sie eine präzise Temperaturkontrolle für Ihre Laborprozesse? Das Verständnis von Phasenübergängen ist entscheidend für Anwendungen wie Materialsynthese, chemische Reinigung und Probenvorbereitung. Bei KINTEK sind wir auf hochwertige Laborgeräte spezialisiert, darunter Öfen, Muffelöfen und Temperaturregelsysteme, die die Genauigkeit und Zuverlässigkeit bieten, die Ihre Forschung erfordert. Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Ausrüstung für Ihre spezifische Anwendung helfen. Kontaktieren Sie uns noch heute, um Ihre Laboranforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Vakuum-Wärmebehandlungs- und Levitation-Induktionsschmelzofen
- Vakuum-Induktionsschmelzspinnanlage Lichtbogen-Schmelzofen
- Labormaßstabs Induktionsschmelzofen mit Vakuum
- Automatische beheizte hydraulische Pressmaschine mit beheizten Platten für Labor-Heißpresse 25T 30T 50T
- Beheizte Hydraulische Pressmaschine mit integrierten manuellen Heizplatten für den Laboreinsatz
Andere fragen auch
- Welche Auswirkung hat eine Wärmebehandlung auf die Korrosionsbeständigkeit? Verbessern Sie die Haltbarkeit mit der richtigen Metallurgie
- Wie erleichtern hochpräzise Rühr- und Dispergiergeräte die Lösungsinterkalation für Nano-Bio-Komposite?
- Ist gesintertes Metall stärker? Der Kompromiss zwischen Festigkeit und Fertigungseffizienz
- Wie beeinflusst die Wärmebehandlung die Mikrostruktur? Das Gleichgewicht zwischen Härte und Zähigkeit meistern
- Was passiert beim Sintern? Pulver in dichte, starke Komponenten umwandeln
- Wie stellen Sie den sicheren Betrieb von Geräten und Maschinen sicher? Ein proaktiver Leitfaden zum Risikomanagement
- Wie nachhaltig ist das selektive Lasersintern? Abwägung von Materialabfall und Energieverbrauch
- Welche Vorsichtsmaßnahmen sind bei der Probenahme zu treffen? Gewährleistung der Datengenauigkeit und Minimierung von Verzerrungen






















