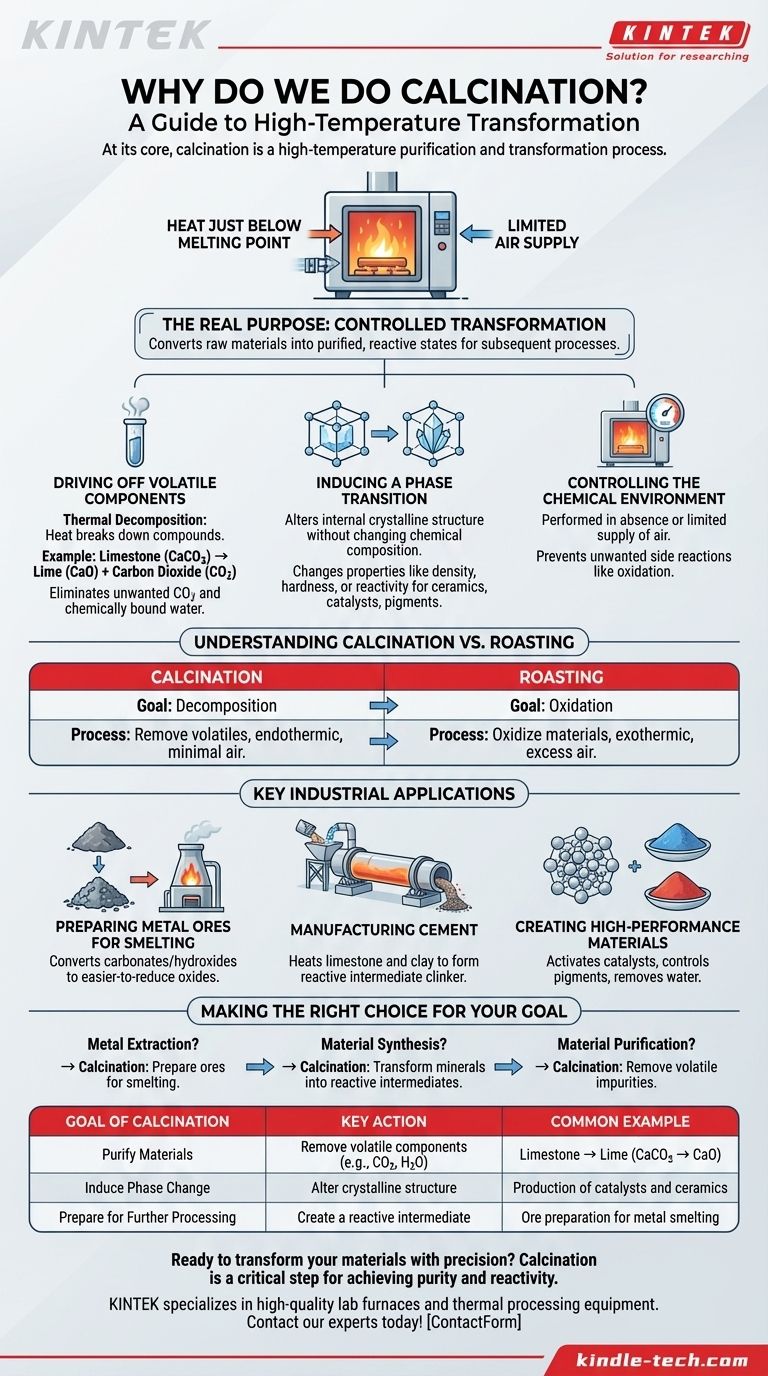
Im Kern ist die Kalzinierung ein Hochtemperatur-Reinigungs- und Umwandlungsprozess. Dabei wird ein fester Werkstoff auf eine Temperatur knapp unter seinen Schmelzpunkt erhitzt, typischerweise bei begrenzter Luftzufuhr. Diese intensive Hitze wird genutzt, um flüchtige Substanzen auszutreiben, eine thermische Zersetzung zu bewirken oder eine Änderung der physikalischen Struktur des Materials auszulösen, um es für seinen nächsten Einsatz vorzubereiten.
Der eigentliche Zweck der Kalzinierung ist nicht nur das Erhitzen, sondern die kontrollierte Umwandlung. Es ist der entscheidende Schritt, der rohe, oft inerte Materialien wie Erze in einen gereinigten und chemisch reaktiveren Zustand überführt, wodurch nachfolgende Prozesse wie die Metallgewinnung oder Zementherstellung möglich und effizient werden.

Die Kernmechanismen der Kalzinierung
Um zu verstehen, warum die Kalzinierung in der Materialwissenschaft und Industrie so grundlegend ist, muss man zunächst die Veränderungen verstehen, die sie bewirkt. Bei dem Prozess geht es nicht nur um das Trocknen einer Substanz; es geht darum, eine grundlegende chemische oder physikalische Veränderung herbeizuführen.
Austreiben flüchtiger Bestandteile
Der häufigste Zweck der Kalzinierung ist die thermische Zersetzung. Dies ist eine chemische Reaktion, bei der Hitze eine Verbindung in zwei oder mehr einfachere Substanzen zerlegt.
Ein klassisches Beispiel ist die Herstellung von Branntkalk aus Kalkstein. Kalkstein (Calciumcarbonat, CaCO3) wird erhitzt, wodurch er zu Branntkalk (Calciumoxid, CaO) zerfällt und Kohlendioxid (CO2)-Gas freigesetzt wird.
Dieser Prozess eliminiert das flüchtige CO2, das im Endprodukt unerwünscht ist, und hinterlässt den nützlichen, reaktiven Branntkalk. Das gleiche Prinzip gilt für die Entfernung chemisch gebundenen Wassers (Hydrate) aus Mineralien.
Auslösen eines Phasenübergangs
Manchmal besteht das Ziel nicht darin, die chemische Zusammensetzung zu ändern, sondern die innere Kristallstruktur des Materials zu verändern. Dies wird als Phasenübergang bezeichnet.
Erhitzen kann die Atome in einem Festkörper neu anordnen und so seine Eigenschaften wie Dichte, Härte oder Reaktivität verändern, ohne einen Teil davon zu entfernen. Dies ist ein entscheidender Schritt bei der Herstellung bestimmter Keramiken, Katalysatoren oder Pigmente, bei denen eine spezifische Kristallstruktur für die Leistung erforderlich ist.
Kontrolle der chemischen Umgebung
Die Kalzinierung wird fast immer in Abwesenheit oder bei begrenzter Zufuhr von Luft durchgeführt. Dies ist ein entscheidender Unterschied. Das Ziel ist es, das Material durch Hitze zu zersetzen, nicht es zu verbrennen oder zu oxidieren.
Durch die Kontrolle der Atmosphäre im Ofen – sei sie inert, reduzierend oder mit sehr wenig Sauerstoff – können Ingenieure unerwünschte Nebenreaktionen verhindern und sicherstellen, dass die gewünschte Umwandlung sauber abläuft.
Den Hauptunterschied verstehen: Kalzinierung vs. Rösten
Der Begriff „Rösten“ wird oft im Zusammenhang mit Kalzinierung verwendet, aber es handelt sich um grundlegend unterschiedliche Prozesse mit gegensätzlichen Zielen. Die Verwechslung der beiden führt zum Prozessversagen.
Das Ziel der Kalzinierung: Zersetzung
Wie bereits erwähnt, zielt die Kalzinierung darauf ab, ein Material zu zersetzen, oft durch Entfernung eines flüchtigen Bestandteils wie CO2 oder H2O. Es handelt sich typischerweise um einen endothermen Prozess (erfordert Energieeinspeisung) und wird bei minimaler Luftzufuhr durchgeführt, um eine Oxidation zu verhindern.
Das Ziel des Röstens: Oxidation
Rösten hingegen wird mit einem Überschuss an Luft oder Sauerstoff durchgeführt. Sein spezifischer Zweck ist die Oxidation des Materials. Dies ist in der Metallurgie üblich, um Metallsulfiderze in Metalloxide umzuwandeln, die später leichter zu reinem Metall reduziert werden können. Der Prozess ist oft exotherm (er setzt Wärme frei).
Wichtige industrielle Anwendungen
Die Kalzinierung ist keine obskure Labortechnik; sie ist ein Eckpfeiler mehrerer riesiger globaler Industrien.
Vorbereitung von Metallerzen für das Schmelzen
In der Metallurgie liegen viele Metalle in der Natur als Carbonate oder Hydroxide vor. Die Kalzinierung ist der wesentliche erste Schritt, um diese Erze in ihre Oxidformen umzuwandeln. Diese Oxide lassen sich in einem Schmelzofen viel leichter reduzieren (der Sauerstoff wird entfernt), um das reine Metall zu gewinnen.
Herstellung von Zement
Die Herstellung von Portlandzement ist eine der großtechnischen Anwendungen der Kalzinierung. Rohstoffe, hauptsächlich Kalkstein und Ton, werden in einem riesigen Drehrohrofen erhitzt.
Die intensive Hitze kalziniert den Kalkstein zu Branntkalk und ermöglicht ihm die Reaktion mit den anderen Mineralien zur Bildung einer neuen Substanz, dem sogenannten Klinker. Dieser Klinker ist das reaktive Zwischenprodukt, das beim Mahlen zu Pulver zu Zement wird.
Herstellung von Hochleistungswerkstoffen
Die Kalzinierung wird auch in kleinerem Maßstab zur Herstellung spezieller Materialien eingesetzt. Sie kann zur Aktivierung von Katalysatoren, zur Steuerung der endgültigen Farbe und Eigenschaften von Pigmenten oder zur Entfernung von Wasser aus Materialien wie Gips zur Herstellung von Stuck (Gips) verwendet werden.
Die richtige Wahl für Ihr Ziel treffen
Die Anwendung der Kalzinierung ist immer an ein spezifisches Umwandlungsziel gebunden.
- Wenn Ihr Hauptaugenmerk auf der Metallgewinnung liegt: Die Kalzinierung ist der wesentliche Vorbereitungsschritt, um Carbonat- oder Hydroxiderze in Oxide umzuwandeln, die viel leichter zu reinem Metall reduziert werden können.
- Wenn Ihr Hauptaugenmerk auf der Materialsynthese (wie Zement) liegt: Die Kalzinierung ist der zentrale chemische Motor, der rohe, inaktive Mineralien in ein hochreaktives Zwischenprodukt wie Klinker umwandelt.
- Wenn Ihr Hauptaugenmerk auf der Materialreinigung liegt: Die Kalzinierung dient dazu, flüchtige Verunreinigungen wie gebundenes Wasser oder kohlenstoffhaltige Verbindungen zu entfernen, um ein stabiles und reines Endprodukt zu erzeugen.
Letztendlich ist die Kalzinierung der grundlegende thermische Prozess zur Umwandlung von Rohstoffen in wertvolle, funktionale Produkte.
Zusammenfassungstabelle:
| Ziel der Kalzinierung | Schlüsselaktion | Häufiges Beispiel |
|---|---|---|
| Materialien reinigen | Flüchtige Bestandteile entfernen (z. B. CO2, H2O) | Kalkstein → Branntkalk (CaCO3 → CaO) |
| Phasenwechsel bewirken | Kristallstruktur verändern | Herstellung von Katalysatoren und Keramiken |
| Für weitere Verarbeitung vorbereiten | Reaktives Zwischenprodukt erzeugen | Erzvorbereitung für das Metallschmelzen |
Bereit, Ihre Materialien präzise zu transformieren? Die Kalzinierung ist ein kritischer Schritt zur Erzielung von Reinheit und Reaktivität in Ihren Produkten. KINTEK ist spezialisiert auf hochwertige Laboröfen und thermische Verarbeitungsanlagen, die für zuverlässige Kalzinierungsprozesse ausgelegt sind. Ob Sie in der Metallurgie, der Zementherstellung oder der Synthese fortschrittlicher Materialien tätig sind, unsere Lösungen gewährleisten kontrollierte, effiziente Ergebnisse. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir Ihre spezifischen Anforderungen an die thermische Verarbeitung unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Elektrische Drehrohrofen-Pyrolyseofenanlage Kalzinator Kleiner Drehrohrofen Rotierender Ofen
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Elektrischer Drehrohrofen Kontinuierlicher Betrieb Kleine Drehrohrofen Heizpyrolyseanlage
- Rotationsrohrofen mit geteilter Mehrfachheizzone
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
Andere fragen auch
- Ist Pyrolyseöl eine Chemikalie? Das Potenzial eines komplexen chemischen Rohstoffs erschließen
- Welche Kernprozessfunktion erfüllt ein Labortrockenschrank bei der Beschichtungsmodifikation von Glasfasermembranen?
- Warum müssen PEO- und Lithiumsalz-Rohmaterialien in einem Vakuumtrockenschrank vorbehandelt werden? Gewährleistung der Batteriestabilität
- Was ist der Unterschied zwischen RF-Sputtern und DC-Sputtern? Wählen Sie die richtige Methode für Ihr Material
- Welche Auswirkung hat das Sintern auf die Härte? Maximieren Sie Materialfestigkeit & Haltbarkeit
- Was ist das Prinzip des Sputter-Coaters für REM? Erzielen Sie hochwertige Bilder mit einer leitfähigen Beschichtung
- Was ist Gleichstrom-Magnetron-Sputtern? Ein Leitfaden zur Abscheidung hochwertiger Dünnschichten
- Wie funktioniert ein Hochleistungs-Mischer mit einstellbarer Drehzahl bei dynamischen Korrosionstests? Verbesserung der Feuerfest-Simulation



















